Około połowa wszystkich białek znajduje się w ludzkim ciele Glikoproteiny. Substancje te odgrywają rolę zarówno jako składniki komórki, jak i substancje odpornościowe. Powstają głównie w ramach tak zwanej N-glikozylacji i jeśli nie zostaną prawidłowo zmontowane, mogą powodować poważne choroby.
Co to są glikoproteiny?
Glikoproteiny to białka z rozgałęzionymi resztami heteroglikanów przypominającymi drzewa. Zwykle mają lepką konsystencję. Makrocząsteczki zawierają kowalencyjnie związane grupy cukrów.
Składają się z monosacharydów, takich jak glukoza, fruktoza, mannoza lub acetylowany aminocukier. Dlatego są również znane jako oligosacharydy związane z białkami. Wiązanie kowalencyjne może zachodzić na różne sposoby i odpowiada albo wiązaniu z aminokwasami seryny lub asparaginy. Wiązanie z seryną nazywa się O-, a wiązanie z N-glikozylacją asparaginy. Glikoproteiny zaangażowane w N-glikozylację różnią się wielkością. Odpowiadają one monosacharydom, di- lub oligosacharydom, a nawet polisacharydom.
W zależności od proporcji monosacharydów dzieli się je na glikoproteiny o wysokiej zawartości mannozy, złożone i hybrydowe. W grupie bogatej w mannozę przeważają reszty mannozy. W grupie złożonej przeważają sacharydy. Grupa hybrydowa jest hybrydą. Zawartość węglowodanów w glikoproteinach wynosi od kilku procent w przypadku rybonukleaz do 85 procent w przypadku antygenów grup krwi.
Funkcja, efekt i zadania
Glikoproteiny pełnią w ludzkim organizmie wiele funkcji. Są składnikiem strukturalnym błon komórkowych iw tym kontekście nazywane są również białkami strukturalnymi. Występują również w śluzie i są stosowane jako lubrykanty w płynach.
Jako białka błonowe przyczyniają się do interakcji komórkowych. Niektóre glikoproteiny pełnią również funkcje hormonalne, takie jak czynnik wzrostu hCG. Substancje te są równie ważne jak składniki immunologiczne w postaci immunoglobulin i interferonów. Wszystkie białka eksportowe i białka błonowe organizmu były nadal glikoproteinami, przynajmniej podczas biosyntezy. Są szczególnie istotne dla reakcji rozpoznawania w układzie odpornościowym, ponieważ oddziałują z immunologicznymi komórkami T i receptorami komórek T. W ludzkim osoczu krwi wyizolowano różne białka osocza, z których tylko albumina i prealbumina nie zawierają reszt cukrowych.
Obfitość glikoprotein jest niesamowita. Ostatecznie prawie wszystkie rozpuszczalne pozakomórkowo białka i enzymy zawierają reszty cukrowe. Jako hormony, glikoproteiny mają działanie plejotropowe i dlatego mają kluczowe znaczenie dla aktywności różnych układów narządów. Hormony TSH, HCG i FSH to na przykład glikoproteiny. Jako białka błonowe pełnią rolę receptorów, a także transporterów i stabilizatorów. Działają stabilizująco, zwłaszcza razem z glikolipidami. Wraz z tymi substancjami tworzą tzw. Glikokaliks, który stabilizuje komórki bez ściany komórkowej.
Edukacja, występowanie, właściwości i optymalne wartości
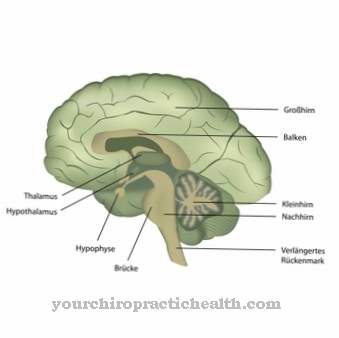
Najczęstszym tworzeniem glikoprotein jest wiązanie N-glikozydowe lub N-glikozylacja do asparaginy. Cukier wiąże się z wolnymi od azotu kwasowymi grupami amidowymi. W siateczce endoplazmatycznej zachodzi N-glikozylacja. Powstałe w ten sposób N-glikozydy są najważniejszą grupą glikoprotein.
W N-glikozylacji, prekursor cukru snytetyzuje na cząsteczce nośnikowej dolicholu, niezależnie od sekwencji aminokwasowej białka docelowego. Grupa OH na końcu cząsteczki jest połączona z difosforanem. Prekursor oligosacharydu tworzy się na końcowej reszcie fosforanowej cząsteczek. Pierwsze siedem cukrów gromadzi się po stronie cytozolowej. Do fosforanu dolicholu przyłączone są dwie N-acetyloglukozaminy i pięć reszt manozy. Jako donory pojawiają się nukleotydy cukrowe GDP-mannoza i UDP-N-acetyloglukozamina. Prekursor jest transportowany przez błonę ER poprzez białko transportowe.
Prekursor jest więc zorientowany w kierunku wnętrza retikulum endoplazmatycznego, do którego dodaje się cztery reszty mannozy. Ponadto hoduje się reszty glukozy. Prekursor o długości 14 cukrów jest ostatecznie przenoszony do białka. Inną ścieżką tworzenia glikoprotein jest wiązanie O-glikozydowe lub O-glikozylacja do seryny, która zachodzi w aparacie Golgiego komórek. Cukier jest związany z grupą hydroksylową seryny. Wartości glikoprotein są szczególnie istotne w odniesieniu do białek osocza, ponieważ odgrywają rolę w pełnej morfologii krwi. Wymienienie w tym momencie wszystkich normalnych wartości dla poszczególnych glikoprotein wykraczałoby poza zakres.
Choroby i zaburzenia
Niektóre choroby genetyczne mają wpływ na glikozylację. Jedną z grup takich chorób jest CDG. Glikoproteiny wykazują nieprawidłowe wartości. Osoby dotknięte chorobą cierpią na spowolniony rozwój, który dotyczy zarówno problemów fizycznych, jak i psychicznych.
Zez może być kolejnym objawem choroby genetycznej. W tworzeniu glokoprotein bierze udział w sumie około 250 różnych genów. W przypadku wrodzonych zaburzeń glikozylacji zaburzenia w przyłączaniu łańcuchów bocznych węglowodanów do białek mają podłoże genetyczne. W modyfikacji potranslacyjnej białka uzyskują pełną funkcjonalność. W tym procesie, gdy enzymy lub białka budujące węglowodanowe łańcuchy boczne są nieprawidłowo złożone razem, powstaje CDG. Na N-glikozylację najczęściej wpływają zaburzenia. Do tej pory odkryto około 30 defektów enzymów, które mają wpływ na N-glikozylację.
Nieco rzadsze są genetyczne zaburzenia O-glikozylacji. Objawiają się wieloukładowymi chorobami nerwowo-mięśniowymi, takimi jak zespół Walkera-Warburga. Ponieważ glikoproteiny pełnią w organizmie tak wiele funkcji, obraz kliniczny charakteryzuje się różnorodnością objawów. Wrodzone zaburzenia glikozylacji mogą mieć wpływ na wszystkie układy narządów. Głównym objawem są zaburzenia rozwoju psychomotorycznego. Nieprawidłowości neurologiczne są równie powszechne. Nierzadkie są również zaburzenia krzepnięcia lub zaburzenia endokrynologiczne.

.jpg)







.jpg)


.jpg)