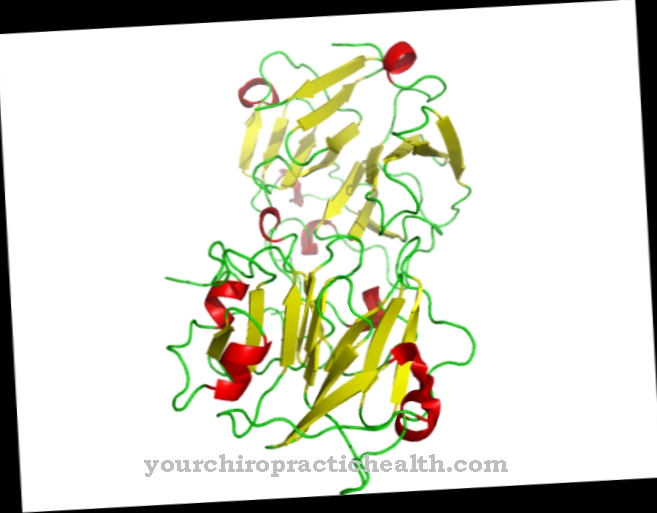
Plik Oksydaza aldehydowa to enzym rozkładający aldehydy u kręgowców. Można go znaleźć w różnych tkankach ssaków i ludzi. Dokładna funkcja oksydazy aldehydowej nie jest jeszcze znana.
Co to jest oksydaza aldehydowa?
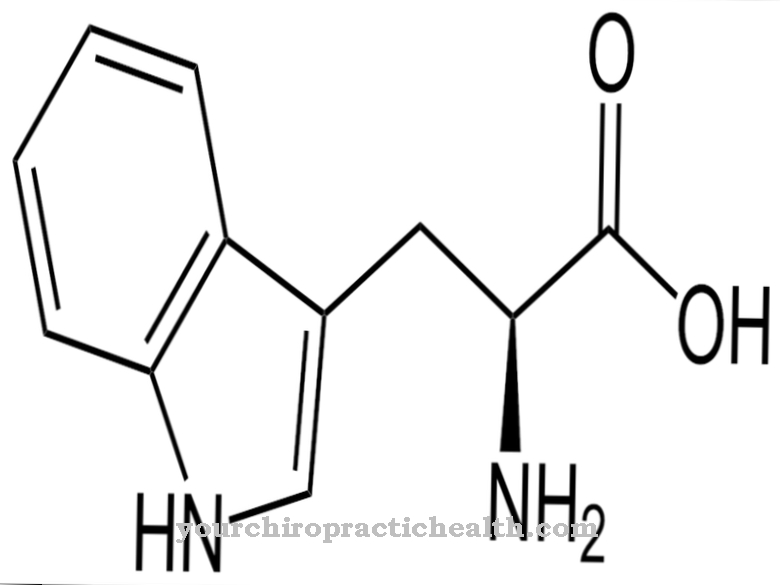
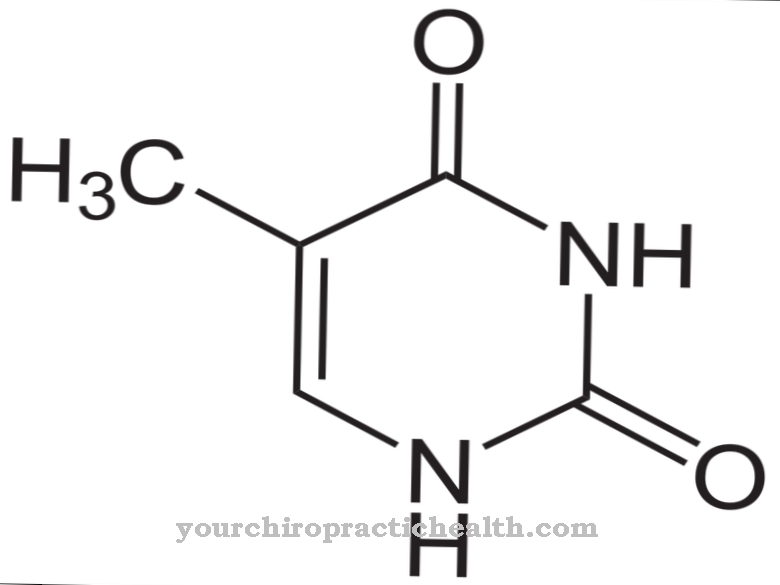
Oksydaza aldehydowa (AOX1) pomaga w enzymatycznym rozkładzie aldehydów w organizmie. Stwierdzono jednak, że rozkłada również nikotynę na kotyninę. Atom tlenu jest wbudowany w beztlenową nikotynę, tworząc strukturę aldehydową.
Z tego powodu oksydaza aldehydowa jest również ważna dla metabolizmu tryptofanu i tym samym dla biotransformacji. Występuje głównie w cytozolu komórek wątroby, trzustki, płuc, mięśni szkieletowych lub komórek tłuszczowych. Kofaktor molibden jest bardzo ważny dla aktywności enzymu. W ludzkim DNA jest tylko jeden gen AOX, który może kodować funkcjonalny enzym. U innych kręgowców aktywnych jest kilka genów AOX. Oksydaza aldehydowa jest bardzo podobna do enzymu dehydrogenazy ksantynowej i jest z nim spokrewniona.
Oba enzymy mogą przekształcić hipoksantynę w ksantynę poprzez pochłanianie atomu tlenu i cząsteczki wody. Jednak konwersja ksantyny do kwasu moczowego zachodzi tylko przez wodorazę ksantynową (oksydaza ksantynowa). Oksydaza aldehydowa składa się z 1338 aminokwasów. Molibdopteryna, FAD i 2 (2Fe2S) służą jako kofaktory ich skuteczności. Charakteryzująca się już nazwą reakcja charakteryzuje się przemianą aldehydów z dodatkiem tlenu i wody do kwasów karboksylowych i nadtlenku wodoru.
Funkcja, efekt i zadania
Enzym oksydaza aldehydowa katalizuje kilka reakcji. W przeważającej części odpowiada za przemianę aldehydów do kwasów karboksylowych z dodatkiem tlenu i wody. Ogólnie oksydaza aldehydowa pośredniczy w dodawaniu atomu tlenu do podłoża.
Między innymi katalizuje również konwersję nikotyny do konityny. Dlatego też odgrywa ważną rolę w biotransformacji i metabolizmie tryptofanu. Molibden jest zawsze potrzebny jako kofaktor w tych reakcjach. W ramach biotransformacji przekształca ksenobiotyki z grupami aldehydowymi w odpowiednie kwasy karboksylowe w pierwszej fazie reakcji. W drugiej fazie reakcji kwas glukuronowy jest przyłączany do grup karboksylowych w celu zwiększenia rozpuszczalności w wodzie i wypłukania obcej cząsteczki z organizmu.
Strukturalnie i chemicznie oksydaza aldehydowa jest blisko spokrewniona z homologicznym enzymem wodorazą ksantynową (oksydaza ksantynowa). Nie wiadomo jednak, dlaczego konwersja ksantyny do kwasu moczowego z dodatkiem tlenu i wody jest katalizowana jedynie przez oksydazę ksantynową. Konwersja hipoksantyny do ksantyny jest nadal katalizowana przez oba enzymy. Ponadto oksydaza aldehydowa jest również odpowiedzialna za adipogenezę (reprodukcję komórek tłuszczowych).
Stymuluje wydzielanie hormonu tkankowego adiponektyny. Z kolei adiponektyna zwiększa skuteczność działania insuliny. W hepatocytach adiponektyna z kolei hamuje uwalnianie oksydazy aldehydowej. Niedobór oksydazy aldehydowej (AOX1) również hamuje eksport lipidów z komórek. Dokładna funkcja oksydazy aldehydowej nie została jeszcze w pełni poznana.
Edukacja, występowanie, właściwości i optymalne wartości
Oksydaza aldehydowa znajduje się głównie w cytoplazmie komórek wątroby. Jednak występuje również w komórkach tłuszczowych, tkance płucnej, mięśniach szkieletowych i trzustce. Kiedyś mylono ją z homologiczną oksydazą ksantynową.
Oba enzymy mają podobną strukturę. Jednak czasami katalizują różne reakcje. Oba enzymy do swoich funkcji potrzebują tych samych kofaktorów. Są to molibdopteryna, FAD i 2 (2Fe2S). Jednak oksydaza aldehydowa nie tylko degraduje aldehydy, ale jest również odpowiedzialna za utlenianie związków N-heterocyklicznych, takich jak nikotyna, do kotyniny.
Choroby i zaburzenia
Wraz z dehydrogenazą ksantynową (oksydazą ksantynową) i oksydazą siarczynową, oksydaza aldehydowa jest zależna od kofaktora molibdenu. Molibden jest wbudowany w molibdopteryny jako atom złożony i tworzy kofaktor molibdenu. W przypadku niedoboru molibdenu te trzy enzymy działają słabo.
Dehydrogenaza ksantynowa katalizuje rozkład ksantyny do kwasu moczowego. Enzym oksydaza aldehydowa jest tylko częściowo zaangażowany w ten proces, na przykład gdy hipoksantyna jest rozkładana na ksantynę. Tutaj konkuruje nawet z oksydazą ksantynową. Dlatego nie ma izolowanego niedoboru oksydazy aldehydowej. Jednak oksydaza aldehydowa wspomaga rozkład katecholamin. Oksydaza siarczynowa jest odpowiedzialna za rozkład aminokwasów zawierających siarkę, takich jak cysteina, tauryna czy metionina. Jeśli tego enzymu brakuje, siarczyn nie jest już przekształcany w siarczan. Ze względu na kofaktor molibden, te trzy enzymy zwykle mają wspólny niedobór.
Oczywiście dla każdego z tych enzymów możliwe są izolowane defekty spowodowane mutacjami. Jak dotąd nie opisano jednak obrazu klinicznego z konkretnym niedoborem oksydazy aldehydowej. Niedobór molibdenu wywołany niezrównoważoną dietą występuje bardzo rzadko. Może się to jednak zdarzyć w przypadku żywienia pozajelitowego z niską zawartością molibdenu przez ponad sześć miesięcy. W takich przypadkach częste są tachypnea, tachykardia, silny ból głowy, nudności, wymioty, centralna niedrożność twarzy lub śpiączka. Ponadto istnieją nietolerancje na niektóre aminokwasy. Podwyższone stężenie siarczynów stwierdza się w moczu, natomiast we krwi stwierdza się obniżone stężenie kwasu moczowego.
Jeśli niedobór molibdenu będzie się utrzymywał, może to prowadzić do problemów z rozkładem aminokwasów zawierających siarkę, alergii na siarczyny, wypadania włosów, niskiego poziomu kwasu moczowego we krwi i problemów z płodnością. Większość objawów jest jednak spowodowana niedoborem oksydazy siarczynowej i dehydrogenazy ksantynowej. Tachykardia jest prawdopodobnie spowodowana zwiększonym poziomem adrenaliny lub noradrenaliny (katecholamin), ponieważ ich rozkład jest opóźniony przez brak oksydazy aldehydowej. Niedobór molibdenu może być spowodowany dietą o wyjątkowo niskiej zawartości molibdenu oraz chorobami zapalnymi jelit, takimi jak choroba Leśniowskiego-Crohna z zaburzeniami wchłaniania pożywienia.
Dziedziczny niedobór kofaktora molibdenu spowodowany upośledzoną syntezą molibdopteryny jest śmiertelny, jeśli wszystkie trzy enzymy zawiodą bez leczenia.


.jpg)
.jpg)


.jpg)
.jpg)