Tak jak Białka osocza nazywane są białkami osocza krwi. Różnią się od białek surowicy przede wszystkim czynnikami krzepnięcia. Białka osocza pełnią wiele funkcji w organizmie i mogą być obciążone objawami niedoboru w kontekście różnych chorób.
Co to są białka osocza?
Specjalista medyczny rozumie, że białka osocza są białkami osocza krwi, znanymi również jako Białko krwi są wyznaczone. Osocze różni się od surowicy krwi czynnikami krzepnięcia, które również należą do białek osocza. W sumie w osoczu krwi znajduje się około stu różnych białek i glikoprotein. Białka stanowią około sześciu do ośmiu gramów na każde 100 mililitrów osocza krwi. Termin białko surowicy należy odróżnić od białek osocza.
Białka surowicy to wszystkie białka krwi bez czynnika krzepnięcia fibrynogenu. Białka osocza można podzielić na albuminy i globuliny za pomocą elektroforezy. Oznacza to, że białka w osoczu krwi, jako naładowane koloidalne części lub cząsteczki, dzielą się na albuminy i globuliny podczas migracji przez pole elektryczne. Te dwie grupy są obecne w osoczu w przybliżonym stosunku 40 do 60 procent.
Anatomia i budowa
Globuliny to α1-, α2-, γ- lub β-globuliny. Ruchliwość elektroforetyczna tych czterech podgrup jest ich główną cechą wyróżniającą. Oprócz około czterech procent globulin α1, osocze zawiera również około osiem procent globulin α2 i dwanaście procent β-globulin. Γ-globuliny stanowią największą część osocza krwi (16%). Biosynteza białek osocza zachodzi głównie w wątrobie i limfie.
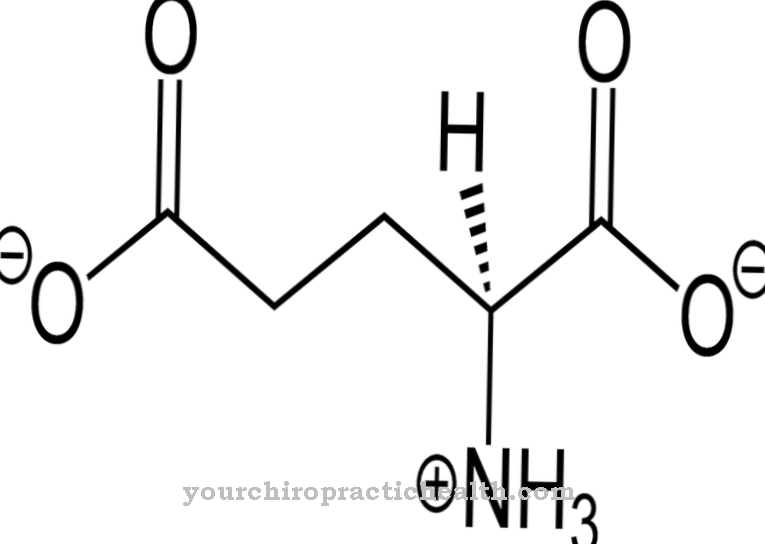
W przypadku glikoprotein translacja odbywa się poprzez modyfikację potranslacyjną. Reszty glikozylowe wiążą się z difosforanem nukleozydów w swojej aktywnej postaci. Wiążą transferazy glikozylowe z białkami. Podobnie jak wszystkie białka, białka osocza są biologicznymi makrocząsteczkami zbudowanymi z aminokwasów. Białka globularne są prawie kuliste w strukturze czwartorzędowej lub trzeciorzędowej. Ponad 100 aminokwasów jest połączonych, tworząc łańcuchy w białkach. Białka osocza krwi są również znane jako białka sferoidalne. Można je łatwo rozpuszczać w wodzie i soli fizjologicznej.
Funkcja i zadania
Białka osocza pełnią w ludzkim ciele różnorodne zadania. Z jednej strony utrzymują koloidalne ciśnienie osmotyczne, co z kolei odgrywa rolę w utrzymaniu objętości plazmy. PH krwi jest również utrzymywane przez białka osocza. Poza tym białko krwi pełni funkcję transportową. Transportują substancje nierozpuszczalne w wodzie przez organizm i dlatego nazywane są również białkami nośnikowymi.
Transport hormonów i enzymów odbywa się również na białkach nośnikowych osocza krwi. Szczególnie niezbędne do krzepnięcia krwi są białka osocza, takie jak fibrynogen, które pomagają w homeostazie. Ponadto białka osocza przejmują ważne zadania w procesach układu odpornościowego, np. W stanach zapalnych. W tym kontekście mówimy również o immunoglobulinach lub przeciwciałach, które powstają w odpowiedzi na antygeny. Immunoglobuliny rozpoznają ciała obce i wiążą się z tymi antygenami, aby je zniszczyć. Globuliny α1 obejmują przede wszystkim transkortynę, która jest odpowiedzialna za transport steroidów. Α1-antytrypsyna hamuje działanie proteazy. To samo dotyczy α1-antychymotrypsyny. Białko osocza HDL jest białkiem nośnikowym dla lipidów krwi.
Protrombina działa jako proenzym trombiny, a transkobalamina transportuje kobalaminę do krwiobiegu. Globuliny α2 obejmują haptoglobinę, która wiąże i transportuje hemoglobinę. α2-makroglobulina i α2-antytrombina hamują krzepnięcie krwi, podczas gdy ceruloplazmina transportuje miedź. Transferryna odpowiedzialna za transport żelaza jest jedną z β-globulin. β-lipoproteina transportuje lipidy we krwi, podczas gdy fibrynogen jest znany jako czynnik krzepnięcia krwi. Hemopeksyna jest końcową β-globuliną i wiąże wolny hem. Immunoglobuliny należą do piątej grupy globulin, których składniki są również znane jako γ-globuliny.
Choroby
W dysproteinemii dochodzi do przesunięć w stosunku ilościowym białek krwi. Zjawisko to może być wrodzone lub nabyte. Nabyta dysproteinemia może być spowodowana na przykład ostrymi infekcjami. W tym przypadku udział albumin maleje, a globulin wzrasta. Zjawisko to może również wystąpić przy dużej utracie krwi lub po operacji. Należy dokonać rozróżnienia między tymi nabytymi postaciami dysproteinemii, wrodzonej nieprawidłowej dystrybucji, jak ma to miejsce w przypadku niedoboru alfa-1-antytrypsyny.
Z powodu defektu genetycznego wytwarza się zbyt mało alfa-1-antytrypsyny. W przypadku genetycznego niedoboru poszczególnych białek osocza mówi się również o defektach proteinemii. Należy rozróżnić paraproteinemię. W przebiegu tej choroby coraz częściej powstają określone immunoglobuliny lub łańcuchy immunoglobulin. Takie procesy zachodzą na przykład w kontekście choroby Waldenströma. Jest to złośliwa choroba chłoniaka, w której komórki chłoniaka wytwarzają nadprodukcję immunoglobuliny M. W szpiczaku mnogim występuje również nadmierne stężenie immunoglobulin. W tym raku szpiku kostnego komórki wytwarzające przeciwciała namnażają się w osoczu krwi.
Te zdegenerowane komórki plazmatyczne wytwarzają nadmiar przeciwciał lub fragmentów przeciwciał. W połączeniu z białkami osocza może wystąpić zarówno hipoproteinemia, jak i hiperproteinemia. W pierwszym przypadku stężenie białek osocza spada poniżej 66 gramów na litr. Z drugiej strony, w hiperproteinemii stężenie wynosi ponad 83 gramy na litr. Przyczyną hipoproteinemii może być na przykład uszkodzenie wątroby lub niedożywienie. Z drugiej strony hiperproteinemia zwykle wiąże się z procesami zapalnymi i może wystąpić np. W kontekście gruźlicy.


.jpg)

.jpg)
.jpg)


.jpg)
.jpg)