Biokatalizator Oksydaza siarczynowa powoduje przemianę toksycznych związków siarki z rozpadu aminokwasów w nietoksyczne siarczany.
Jest niezbędna i dlatego występuje we wszystkich organizmach. Jeśli jego funkcja jest zaburzona przez defekt genetyczny, dochodzi do niedoboru oksydazy siarczynowej. Zbyt wysoka zawartość siarczynu we krwi może mieć również negatywny wpływ na zdrowych pacjentów.
Co to jest oksydaza siarczynowa?
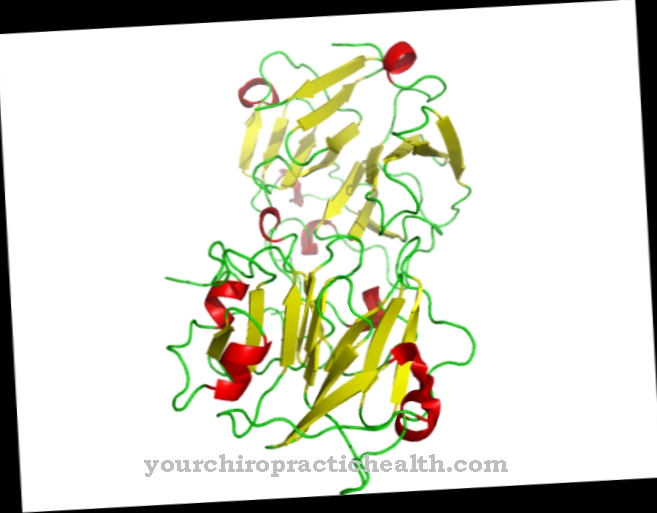
Oksydaza siarczynowa (nazwa genu: SUOX) to nazwa enzymu zawierającego molibden, który składa się z 466 aminokwasów. Należy do rodziny dehydrogenaz ksantynowych i występuje w prawie wszystkich organizmach. W swoim środku zawiera molibden, ważny pierwiastek śladowy.
Metal występuje tam w swojej biodostępnej postaci jako anion molibdenianowy. Oksydaza siarczynowa wykorzystuje go jako kofaktor (związek molibdenian-molibdopteryna). Enzym przekształca aminokwasy zawierające siarkę, metioninę, cysteinę itp., Które są przyjmowane z pożywieniem, w nieszkodliwe sole siarki (siarczany), które są następnie wydalane z moczem. U ssaków biokatalizator rozkładający siarkę występuje głównie w wątrobie i nerkach. Enzym oksydaza siarczynowa zapewnia połączenie tlenu we krwi z niezbędnymi aminokwasami i innymi substancjami zawierającymi siarkę.
Uwolnione elektrony są wykorzystywane przez łańcuch transportu elektronów do produkcji ATP (trifosforan adenozyny). Enzym katalizuje codziennie 10 razy więcej siarczynów, jakie znajdują się w jednym litrze alkoholu.
Funkcja, efekt i zadania
Każdy codziennie spożywa białka zawierające siarkę i dodatki do żywności. Te ostatnie są zawarte w marynowanych warzywach, soku grejpfrutowym itp. I mają na celu ochronę żywności przed inwazją drobnoustrojów i przebarwieniami. W winie tworzą substancje bukietu.
W wyniku rozkładu samej cysteiny w organizmie każdego dnia wytwarza się 1680 mg toksycznego siarczynu, który musi zostać natychmiast przetworzony przez oksydazę siarczynową, aby narządy i tkanki nie zostały uszkodzone. Enzym działa razem z innymi biokatalizatorami. Siarczyny są trujące i mogą nawet w najmniejszych ilościach niszczyć substancje witalne w organizmie i hamować niezbędne procesy metaboliczne. Aby móc przeprowadzić ważną detoksykację komórek, oksydaza siarczynowa potrzebuje pierwiastka śladowego molibdenu.
Niedobór tego metalu może prowadzić do poważnych konsekwencji. Zbyt wysoki poziom rtęci w organizmie może również hamować działanie oksydazy siarczynowej.
Edukacja, występowanie, właściwości i optymalne wartości
Oksydaza siarczynowa jest wytwarzana głównie w mitochondriach, „centrach energetycznych” komórek. Na przykład u szczurów 80% zachodzi w mitochondriach komórek wątroby. Ponadto nadal jest silnie reprezentowany w komórkach nerek.
Tlenek molibdenu niezbędny do działania oksydazy siarczynowej znajduje się w centrum aktywnym enzymu. Jak niedawno odkryli naukowcy, nanocząsteczki trójtlenku molibdenu mogą go zastąpić u pacjentów z niedoborem molibdenu. Mają podobny efekt katalityczny w organizmie, jak naturalny enzym. W ten sposób można leczyć wcześniej śmiertelne choroby, takie jak sulfocysteinuria.
Choroby i zaburzenia
Niedobór oksydazy siarczynowej może powodować reakcje astmatyczne, a nawet anafilaktyczne u innych zdrowych ludzi, ponieważ przywspółczulny układ nerwowy wpływa na komórki tuczne odpowiedzialne za rozwój alergii.
Ponadto, jeśli poziom oksydazy siarczynowej jest zbyt niski, może to prowadzić do silnego zmęczenia, bólów głowy i niskiego poziomu cukru we krwi. Jednak niedobór genetyczny enzymu życiowego ma jeszcze gorsze konsekwencje. Noworodek rodzi się z fizycznymi deformacjami i upośledzeniem umysłowym. Ten tak zwany niedobór oksydazy siarczynowej lub sulfocysteinuria występuje jako choroba z niedoborem kofaktora molibdenu (MoCo) w szacunkach od 100 000 do 500 000 urodzeń. Niemowlęta cierpiące na izolowany defekt oksydazy siarczynowej wykazują podobne objawy: ciężką encefalopatię, trudno kontrolowalne napady padaczkowe, spastyczność, małogłowie, rozluźnienie mięśni i postępującą atrofię mózgu.
Ponieważ autosomalna recesywna choroba dziedziczna związana z niedoborem enzymów nie może być obecnie skutecznie leczona, mali pacjenci zwykle umierają w dzieciństwie: Związki siarki, które nie są rozkładane, trujące neurony i osłonki mielinowe ośrodkowego układu nerwowego, gromadzą się w tkance komórkowej. Już po urodzeniu występują problemy z jedzeniem i wymiotami treści żołądkowej. Niemowlęta rodzą się ze zdeformowaną czaszką (wystające czoło, głęboko osadzone oczy, zbyt długie powieki, grube usta, mały nos). W ciągu pierwszych kilku miesięcy życia soczewka przesuwa się w oku.
Około 75% opisanych dotychczas przypadków sulfocysteinurii jest spowodowanych niedoborem MoCo: wszystkie trzy enzymy biorące udział w rozkładzie siarki w organizmie, oksydaza siarczynowa, oksydaza ksantynowa i oksydaza aldehydowa, wykazują znacznie zmniejszoną aktywność. Przyczyną izolowanego niedoboru oksydazy siarczynowej jest mutacja w genie SUOX (chromosom 12). Występuje w trzech wariantach: typ A (mutacja w genie MOCS1), typ B (gen MOCS2) i typ C (gen MOCS3). Najbardziej powszechna jest mutacja typu A. Powstanie cząsteczki prekursora cPMP jest zahamowane. Jednak substancję można teraz wytwarzać i podawać w laboratorium.W celu poprawy przeżycia dziecka należy jak najszybciej zdiagnozować chorobę niedoborową i leczyć codziennym dożylnym podawaniem molibdenianu.
W ten sposób można powstrzymać przynajmniej dalsze szkody. Dziecko otrzymuje leki przeciwskurczowe w celu zwalczania napadów. Muszą być również na diecie niskobiałkowej. Alternatywnie można również podawać prekursor MoCo Z. Zmniejsza napady i zapobiega dalszym uszkodzeniom mózgu. Medycyna wiąże duże nadzieje z leczeniem nieuleczalnej wcześniej choroby nanocząsteczkami trójtlenku molibdenu, które pełnią w organizmie rolę oksydazy siarczynowej. Aby dowiedzieć się, czy nienarodzone dziecko ma niedobór oksydazy siarczynowej, kobieta w ciąży może zbadać poziom S-sulfocysteiny w płynie owodniowym.

.jpg)





.jpg)




.jpg)
.jpg)

.jpg)