Białko Tropomiozyna występuje głównie w mięśniach poprzecznie prążkowanych i uczestniczy w skurczach mięśni. Mutacje genetyczne mogą wpływać na strukturę wytwarzanych cząsteczek tropomiozyny i tym samym powodować szereg chorób - w tym różne postacie kardiomiopatii, a także artrogryposis multiplex congenita i miopatię nemalinową.
Co to jest tropomiozyna?
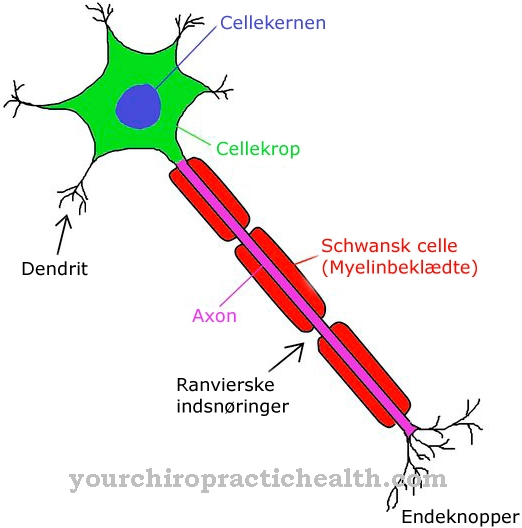
Tropomiozyna to białko występujące w organizmie człowieka głównie w mięśniach szkieletowych. Biochemik Kenneth Bailey po raz pierwszy opisał białko w 1946 roku. Pojedynczy mięsień składa się z wielu wiązek włókien mięśniowych, które z kolei składają się z włókien mięśniowych.
Każde włókno nie składa się z pojedynczej, wyraźnie określonej komórki mięśniowej, ale z tkanki o wielu jądrach komórkowych. W tych jednostkach miofibryle reprezentują drobniejsze włókna; ich przekroje poprzeczne nazywane są sarkomerami. Sarkomer składa się z dwóch rodzajów pasm, które są naprzemiennie wpychane w siebie, jak koło zębate lub zamek błyskawiczny. Niektóre z tych nici to miozyna, inne to kompleks aktyny i tropomiozyny. W tym złożonym cząsteczce aktyny tworzą gruby łańcuch, wokół którego nawinięte są dwie nici tropomiozyny.
Anatomia i budowa
Tropomiozyna składa się z dwóch części: α i β. Dwa bloki budulcowe mają łącznie 568 aminokwasów, z których 284 to α-tropomiozyna, a 284 to β-tropomiozyna. Aminokwasy te ustawiają się w rzędzie i tworzą długie łańcuchy, zanim ostatecznie połączą się, tworząc makrocząsteczkę w kształcie pręta.
Sekwencja aminokwasów i struktura białka są zdeterminowane genetycznie; u ludzi odpowiedzialne są za to następujące geny: TPM1 na 15. chromosomie, TPM2 na 9. chromosomie, TPM3 na pierwszym chromosomie i TMP4 na 19. chromosomie. Pasmo tropomiozyny (z obiema podjednostkami) owija się wokół grubszych włókien aktyny w prążkowanych mięśniach szkieletowych. Dołączona jest również troponina, inne białko.
Funkcja i zadania
Tropomiozyna jest wymagana do kurczenia się mięśni szkieletowych. Kiedy impuls nerwowy dociera do mięśnia, bodziec elektryczny początkowo rozprzestrzenia się przez sarkolemmę i kanaliki T, a ostatecznie prowadzi do uwolnienia jonów wapnia w siateczce sarkoplazmatycznej.
Jony tymczasowo wiążą się z troponiną, która znajduje się na nici tropomiozyny. W rezultacie jony wapnia zmieniają właściwości fizyczne cząsteczki. Troponina nieznacznie przesuwa się na powierzchni, a tym samym oddala się od miejsc, z którymi może się wiązać miozyna. Miozyna tworzy włókna komplementarne do kompleksu aktyna / tropomiozyna. Na końcu filamentu miozyny znajdują się dwie tak zwane głowice. Głowice miozyny mogą wiązać się z obszarami filamentu aktyny, które nie są już zajęte przez troponinę.
Po zadokowaniu na włóknie, główki miozyny składają się i wciskają między filamenty aktyny / tropomiozyny, co skraca sarkomer. Jednocześnie proces ten zachodzi nie tylko w jednym sarkomerze, ale w wielu. Liczne skurczone sarkomery powodują zatem kurczenie się włókna mięśniowego, a tym samym całego mięśnia. Sygnał nerwowy często stymuluje kilkaset włókien mięśniowych. Plastyfikujące działanie trójfosforanu adenozyny (ATP) umożliwia główce miozyny oderwanie się od aktyny.
Skurcz mięśni gładkich jest nieco inny. Mięśnie gładkie otaczają narządy u ludzi lub znajdują się w ścianach naczyń krwionośnych. Może kurczyć się bardziej niż mięśnie prążkowane. Podczas gdy mięśnie szkieletowe mają strukturę prążkowaną, mięśnie gładkie tworzą płaską powierzchnię złożoną z pojedynczych komórek. Oprócz aktyny i tropomiozyny w mięśniach gładkich występuje kaldesmon i kalmodulina, dwa inne białka, których wzajemne oddziaływanie wpływa na napięcie mięśni. Tropomiozyna działa głównie na kalmodulinę.
Ponadto tropomiozyna odgrywa również rolę w innych procesach biologicznych. Na przykład wydaje się wpływać na wiązanie aktyny w cytoszkieletu i wpływać na podział komórek.
Choroby
Jedną z chorób, które mogą być związane z tropomiozyną, jest kardiomiopatia przerostowa. Jest to choroba serca, w której sarkomery (odcinki włókien mięśniowych) są pogrubione, co wpływa również na grubość włókien mięśniowych jako całości.
W rezultacie mogą rozwinąć się objawy, takie jak uczucie ucisku w klatce piersiowej, zawroty głowy, duszność, omdlenia i napady dusznicy bolesnej. W tym przypadku wracają do problemów funkcjonalnych mięśnia sercowego. Najczęstsza przyczyna (40–60%) kardiomiopatii przerostowej leży w genach: zmiany (mutacje) prowadzą do błędów w kodzie genetycznym, a tym samym do nieprawidłowej syntezy białek. Może to również wpływać na różne białka tworzące włókna mięśniowe.
W kardiomiopatii restrykcyjnej mięsień sercowy ulega stwardnieniu. Przyczyną jest nadmiar tkanki łącznej. Kardiomiopatia restrykcyjna prowadzi do niewydolności serca, która zwykle charakteryzuje się zaburzeniami oddychania, obrzękiem, suchym kaszlem, zmęczeniem, wyczerpaniem, zawrotami głowy, omdleniami, kołataniem serca i różnymi zaburzeniami trawienia. Osoby dotknięte chorobą rzadziej są zdezorientowane, cierpią na problemy z pamięcią lub upośledzoną zdolność poznawczą. Kardiomiopatia rozstrzeniowa może być również spowodowana błędem w genach tropomiozyny.
Kiedy ta choroba serca się ujawnia, często jest związana z globalną niewydolnością serca i / lub postępującą niewydolnością lewej strony serca. Ponadto mogą pojawić się zaburzenia oddychania, zatorowości i zaburzenia rytmu serca. Dwie inne choroby, które mogą być związane z tropomiozyną i są częściowo oparte na mutacjach, to miopatia nemalinowa, w której mięśnie mogą być uszkodzone na wiele sposobów, oraz artrogryposis multiplex congenita, w którym stawy sztywnieją. Jednak wszystkie te choroby mogą mieć również inne przyczyny; mutacje w genach tropomiozyny są tylko jedną możliwością.


.jpg)
.jpg)


.jpg)
.jpg)