Hydroksylazy lizylowe reprezentują grupę enzymów odpowiedzialnych za hydroksylację reszt lizyny w białkach. Więc głównie przyczyniają się do budowy tkanki łącznej. Zaburzenia funkcji hydroksylazy lizylowych wyrażają się w chorobach takich jak szkorbut czy dziedziczny zespół Ehlersa-Danlosa.
Co to są hydroksylazy lizylowe?
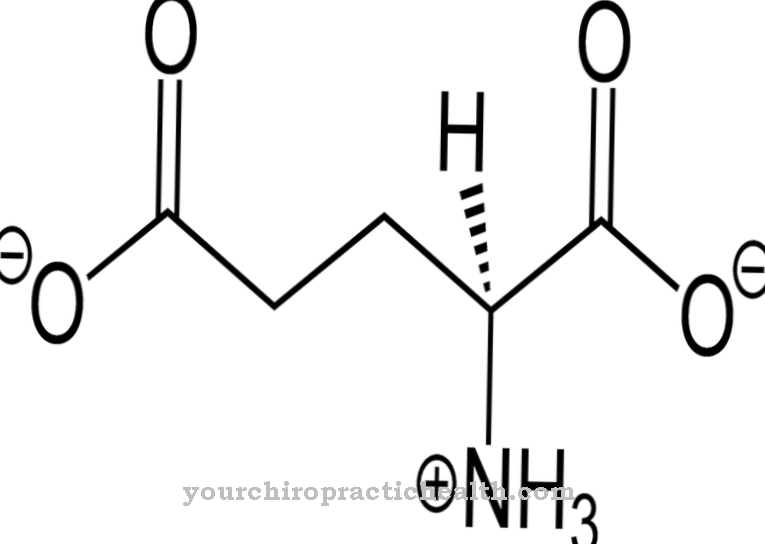
Hydroksylazy lizylowe to enzymy, których zadaniem jest katalizowanie potranslacyjnej modyfikacji aminokwasu lizyny poprzez włączenie grupy hydroksylowej do hydroksylolizyny. To wzmacnia tkankę łączną, ponieważ jej łańcuchy białkowe mają możliwość dalszej sieciowania poprzez grupy hydroksylowe.
Ludzka hydroksylaza lizylowa składa się z 727 aminokwasów. Hydroksylazy lizylowe również należą do grupy hydroksylaz, czyli enzymów, które generalnie katalizują włączanie grup hydroksylowych do cząsteczek. Oprócz hydroksylaz lizylowych, hydroksylazy lub oksydoreduktazy obejmują także hydroksylazy prolilowe, hydroksylazę fenyloalaninową, hydroksylazę tyrozynową lub hydroksylazę tryptofanu. Zwłaszcza razem z hydroksylazami prolilowymi hydroksylazy lizylowe odgrywają ważną rolę w funkcjonowaniu tkanki łącznej. Obie grupy enzymów wymagają koenzymu witaminy C.
Funkcja, efekt i zadania
Funkcja hydroksylazy lizylowej polega wyłącznie na katalizowaniu włączania grup hydroksylowych do reszt lizyny w białku. W wyniku modyfikacji potranslacyjnej aminokwas hydroksyloamina powstaje z lizyny.
Chociaż hydroksyloamina jest również wolna, nie można jej włączyć do białka w tej postaci. Dlatego modyfikacja potranslacyjna oznacza późniejszą konwersję tego aminokwasu po zbudowaniu białka. Kiedy atom wodoru jest wymieniany na grupę hydroksylową, w białku wbudowana jest w tym momencie grupa funkcyjna, która może pełnić funkcje mostkowe. Za pomocą grupy hydroksylowej mogą łączyć się różne łańcuchy białek. Ponadto cząsteczki cukru mogą wiązać się z tą grupą funkcyjną. Obie reakcje są bardzo ważne między innymi w rozwoju tkanki łącznej.
Tkanka łączna otacza organizm i narządy wewnętrzne. Musi być mocna i napięta, aby można było odróżnić funkcjonalnie różne narządy. Zapewniają to białka tkanki łącznej, które zawierają wysoki procent aminokwasów lizyny i proliny.W tym celu oba aminokwasy są następnie częściowo modyfikowane po ich włączeniu do białka poprzez dodanie grupy hydroksylowej. Jak już wspomniano, w przypadku proliny reakcja ta jest katalizowana przez hydroksylazy prolilowe, a lizyna przez hydroksylazy lizylowe. Po utworzeniu białka te reakcje modyfikacji tworzą sieć łańcuchów białkowych, które reprezentują zwartą tkankę łączną.
Bez funkcji obu enzymów rozwój funkcjonalnej tkanki łącznej nie byłby w ogóle możliwy. Jednak oba enzymy działają tylko przy pomocy koenzymu kwasu askorbinowego, czyli witaminy C.W przypadku enzymów zmienionych strukturalnie na skutek mutacji lub braku witaminy C może to prowadzić do zaburzeń w budowie tkanki łącznej, a tym samym do poważnych chorób.
Edukacja, występowanie, właściwości i optymalne wartości
Gen PLOD1 jest odpowiedzialny za kodowanie ludzkiej hydroksylazy lizylowej. Nazwa PLOD1 pochodzi od nazwy hydroksylazy lizylowej „Prokollagen-Lysin, 2-Oxoglutarat-5-Dioxygenase 1”. Ten gen znajduje się na chromosomie 1. Ponieważ stale powstaje nowa tkanka łączna, istnieje również ciągła potrzeba wytwarzania lizylohydroksylaz. Dlatego mutacja tego genu może mieć bardzo poważne konsekwencje dla zdrowia organizmu.
Choroby i zaburzenia
Zaburzenia funkcji hydroksylazy lizylowych odgrywają szczególnie ważną rolę w przypadku szkorbutu i zespołu Ehlersa-Danlosa. Szkorbut jest znany jako starożytna choroba morska, która jest spowodowana brakiem witaminy C. Witamina C, znana również jako kwas askorbinowy, działa jako koenzym hydroksylaz lizylowych i hydroksylaz prolilowych. W przypadku jego braku, lizyna i prolina w białku tkanki łącznej nie mogą już podlegać hydroksylacji.
Ponieważ występuje ciągłe gromadzenie się i rozpad białek tkanki łącznej, łańcuchy białek są coraz mniej zdolne do tworzenia sieci w okresie niedoboru witamin. Tkanka łączna wiotczeje i nie może już prawidłowo spełniać swojej funkcji. Występuje wiele różnych objawów, w tym ogólne wyczerpanie, podatność na infekcje, krwawienie z dziąseł, utrata zębów, słabe gojenie się ran, poważne problemy skórne, zanik mięśni i wiele innych problemów zdrowotnych. Szkorbut może ostatecznie doprowadzić do śmierci z powodu ogólnej niewydolności serca lub ciężkich infekcji. Szczególnie dotkliwie odczuli to starożytni marynarze, którzy nie mogli otrzymać wystarczającej ilości witaminy C podczas długich rejsów morskich.
Wykazano, że choroba leczy się natychmiast po podaniu pewnych pokarmów, takich jak kiszona kapusta. Dopiero później uznano, że przyczyną choroby był niedobór witaminy C. Wybuchowi szkorbutu marynarza zapobiegano później karmiąc marynarzy kiszoną kapustą. Inną chorobą, którą tylko częściowo można przypisać defektowi ludzkiej hydroksylazy lizylowej, jest zespół Ehlersa-Danlosa. Zespół Ehlersa-Danlosa to zbiorcze określenie dla różnych dziedzicznych chorób tkanki łącznej o różnych przyczynach. Zespół ten charakteryzuje się ciężkim osłabieniem tkanki łącznej.
Skóra jest nadmiernie rozciągliwa, a stawy są nadmiernie rozluźniane. Zmodyfikowana genetycznie hydroksylaza lizylowa wyzwala zespół Ehlersa-Danlosa typu VI. Odpowiada za to zmutowany gen o nazwie PLOD1, który znajduje się na chromosomie 1. Powstały w ten sposób wadliwy enzym nie jest już w pełni funkcjonalny i może jedynie w niewystarczającym stopniu katalizować reakcje hydroksylacji lizyny. Powstaje słaba tkanka łączna ze znanymi objawami, a także dodatkowe zajęcie oczu i narządów wewnętrznych. Zespół Ehlersa-Danlosa typu VI może być dziedziczony jako cecha autosomalna recesywna.






.jpg)




.jpg)
.jpg)

.jpg)