Złożone procesy komórkowe i fizjologiczne zachodzące w organizmach żywych wymagają precyzyjnej regulacji na poziomie molekularnym, aby zapewnić przystosowanie zwierzęcia lub rośliny, na przykład, do siedliska. W tym celu istnieje wiele cząsteczek, które interweniują w procesach, takich jak komunikacja komórkowa, metabolizm lub podział komórek. Jedną z tych cząsteczek jest białko Kalmodulinaktóry z pomocą wapnia wpływa na działanie wielu innych biologicznie aktywnych białek.
Co to jest kalmodulina?
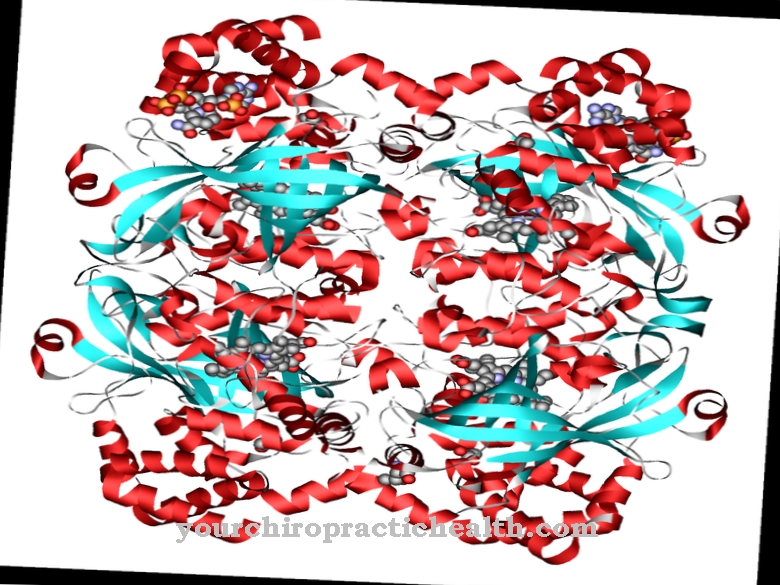
Kalmodulina to wewnątrzkomórkowe białko regulatorowe, które wiąże jony wapnia. Ze względu na swoją budowę należy do grupy białek EF-hand. Kształt kalmoduliny, która składa się ze 148 aminokwasów i ma długość 6,5 nm, przypomina hantle. Masa cząsteczkowa tej cząsteczki białka wynosi około 17 kDa.
Ze względu na swoją biologiczną funkcję w przekazywaniu sygnałów w komórkach kalmodulinę można również sklasyfikować jako drugi przekaźnik, czyli wtórną substancję przekaźnikową, która jednak sama nie jest aktywna enzymatycznie. W dwóch sferycznych domenach białka znajdują się dwa motywy helisa-pętla-helisa w odległości 1,1 nm, do których mogą być przyłączone łącznie cztery jony wapnia. Ta struktura jest znana jako ręka EF. Struktury dłoni EF są połączone wiązaniami wodorowymi między antyrównoległymi arkuszami beta kalmoduliny.
Funkcja, efekt i zadania
Aby kalmodulina była aktywna, potrzebuje od trzech do czterech związanych jonów wapnia na cząsteczkę. W stanie aktywowanym utworzony kompleks wapnia i kalmoduliny bierze udział w regulacji dużej liczby receptorów, enzymów i kanałów jonowych, pełniąc różnorodne funkcje. Regulowane enzymy obejmują fosfatazę kalcyneurynę, która odgrywa ważną rolę w regulacji odpowiedzi immunologicznej, oraz śródbłonkową syntazę tlenku azotu (eNOS), która produkuje NO, który jest używany między innymi do rozluźnienia mięśni gładkich, a tym samym do rozbudowy Naczynia krwionośne.
Przy niskich stężeniach wapnia aktywowana jest także cyklaza adenylanowa (AC), natomiast przy wysokich stężeniach wapnia, z drugiej strony, enzymatyczny odpowiednik fosfodiesterazy (PDE). W ten sposób uzyskuje się chronologiczną sekwencję mechanizmów regulacyjnych: początkowo AC wprawia w ruch ścieżkę sygnału poprzez wytwarzanie cyklicznego AMP (cAMP), później jest ona ponownie wyłączana przez przeciwnika PDE poprzez degradację cAMP. Jednak szczególnie znany jest regulacyjny wpływ kalmoduliny na kinazy białkowe, takie jak kinaza CaM II lub kinaza łańcucha lekkiego miozyny (MLCK), które zostanie wyjaśnione bardziej szczegółowo poniżej.
CAMKII może wiązać resztę fosforanową z różnymi białkami, a tym samym wpływać na metabolizm energii, przepuszczalność jonów i uwalnianie neuroprzekaźników z komórek. CAMKII występuje w szczególnie wysokich stężeniach w mózgu, gdzie odgrywa ważną rolę w plastyczności neuronów, tj. wszystkie procesy uczenia się. Ale kalmodulina jest również niezbędna do procesów ruchowych. W stanie spoczynku stężenie jonów wapnia w komórce mięśniowej jest bardzo niskie, przez co kalmodulina jest nieaktywna. Jeśli jednak komórka mięśniowa jest wzbudzona, wapń napływa do osocza komórkowego i jako kofaktor zajmuje cztery miejsca wiązania kalmoduliny.
To może teraz aktywować kinazę łańcucha lekkiego miozyny, która przesuwa kurczliwe włókna w komórce, a tym samym umożliwia skurcz mięśni. Inne, mniej znane enzymy będące pod wpływem kalmoduliny to cyklaza guanylanowa, Ca-Mg-ATPaza i fosfolipaza A2.
Edukacja, występowanie, właściwości i optymalne wartości
Kalmodulina występuje u wszystkich eukariotów, do których należą wszystkie rośliny, zwierzęta, grzyby i grupa stworzeń ameboidalnych. Ponieważ cząsteczka kalmoduliny w tych organizmach ma zwykle stosunkowo podobną strukturę, można założyć, że jest to białko bardzo stare ewolucyjnie, które pojawiło się na wczesnym etapie.
Z reguły kalmodulina jest obecna w stosunkowo dużych ilościach w osoczu komórki. Na przykład w cytozolu komórek nerwowych typowe stężenie wynosi około 30-50 µM, tj. 0,03-0,05 mol / l. Białko powstaje podczas transkrypcji i translacji z wykorzystaniem genu CALM, którego trzy znane do tej pory allele określane są jako CALM-1, CALM-2 i CALM-3.
Choroby i zaburzenia
Istnieją substancje chemiczne, które mogą hamować działanie kalmoduliny i dlatego są znane jako inhibitory kalmoduliny. W większości przypadków ich działanie hamujące polega na tym, że transportują wapń z komórki, a tym samym usuwają go z kalmoduliny, która jest wtedy obecna tylko w stanie nieaktywnym.
Te substancje hamujące obejmują na przykład W-7. Ponadto niektóre psychotropowe leki fenotiazynowe hamują działanie kalmoduliny. Tak szerokie jak funkcje regulacyjne kalmoduliny, tak różnorodne są możliwe defekty i zaburzenia, kiedy białko nie może być już aktywowane przez kofaktor wapń, a regulowane enzymy docelowe same są mniej aktywne. Na przykład niewystarczająca aktywacja CAMKII może prowadzić do ograniczenia plastyczności neuronalnej, która stanowi podstawę procesów uczenia się.
Zmniejszająca się aktywacja MLCK upośledza skurcz mięśni, co może prowadzić do zaburzeń ruchowych. Mniejsza aktywacja enzymu kalcyneuryny z powodu niedoboru kalmoduliny wpłynęłaby na odpowiedź immunologiczną organizmu, a mniejsza aktywacja eNO prowadziłaby do niższych stężeń NO. Ta ostatnia powoduje głównie problemy, gdzie inaczej tlenek azotu ma zapobiegać niepożądanemu krzepnięciu krwi i rozszerzać naczynia w celu lepszego krążenia krwi. Jednak w tym miejscu należy również wspomnieć, że czujnik wapnia Frequenina może w pewnych warunkach przejąć funkcje biologiczne kalmoduliny i tym samym zastąpić cząsteczkę.







-durch-vitamin-b12-mangel.jpg)