Chymotrypsyna B. należy do enzymów trawiennych. Jest produkowany przez trzustkę i odgrywa ważną rolę w trawieniu białek.
Co to jest chymotrypsyna B?
Chymotrypsyna B jest enzymem trawiennym i należy do proteaz serynowych. Z kolei proteazy serynowe stanowią podgrupę peptydaz. Peptydazy to enzymy, które mogą rozkładać białka.
Proteazy serynowe charakteryzują się tym, że w swoim centrum aktywnym mają aminokwas serynę. Inne enzymy trawienne należące do proteaz serynowych to trypsyna, elastaza i plazmina. Chymotrypsyna B ma bardzo podobny skład chemiczny do trypsyny. Jednak działanie tych dwóch enzymów trawiennych jest nieco inne.
Funkcja, efekt i zadania
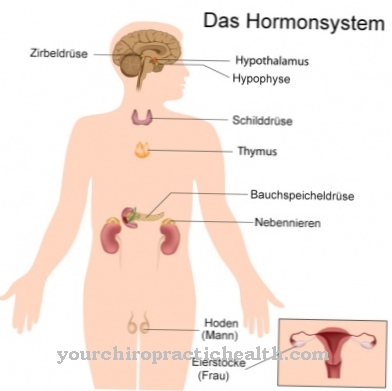
Chymotrypsyna jest wytwarzana w trzustce. Aby trzustka nie trawiła się tym enzymem, najpierw tworzy się w postaci nieaktywnego chymotrypsynogenu. Jest aktywowana w jelicie cienkim przez podobny chemicznie enzym trawienny trypsynę.
Trypsyna jest również uwalniana do jelita cienkiego w nieaktywnej postaci. Jest tam aktywowany przez enterokinazę i ostatecznie może również aktywować chymotrypsynę B. Chymotrypsyna B wraz z wieloma innymi enzymami trawiennymi jest uwalniana do jelita cienkiego w wydzielinach trzustkowych. Trzustka produkuje około półtora litra tej wydzieliny dziennie. Jest silnie zasadowy, ponieważ ma zneutralizować treść pokarmową, która po zmieszaniu z sokiem żołądkowym jest bardzo kwaśna. Enzymy trawienne trzustki nie mogą wykonywać swojej pracy, gdy pH jest kwaśne.
Wydzielanie soku trzustkowego, a tym samym wydzielanie chymotrypsyny B, jest stymulowane przede wszystkim przez hormony cholecystokininę i sekretynę. Cholecystokinina i sekretyna są uwalniane z komórek jelita cienkiego, gdy tylko wejdą w kontakt z kwaśną treściwą treściwą. Z drugiej strony hormony glukagon, somatostatyna, peptyd YY i polipeptyd trzustkowy hamują wydzielanie wydzieliny trzustkowej, w tym jej hormonów. Mniej chymotrypsyny B jest również wydzielane pod wpływem współczulnego układu nerwowego.
Chymotrypsyna B jest wydalana z kałem. Dlatego wartości enzymu trawiennego są również mierzone w kale. W przypadku chymotrypsyny w kale wartość referencyjna> 6 U / g kału dotyczy dorosłych. Wartość chymotrypsyny dostarcza informacji na temat funkcji trzustki. Zwiększone wydalanie chymotrypsyny nie ma wartości chorobowej. Obniżona wartość może wskazywać na funkcjonalne osłabienie trzustki.
Edukacja, występowanie, właściwości i optymalne wartości
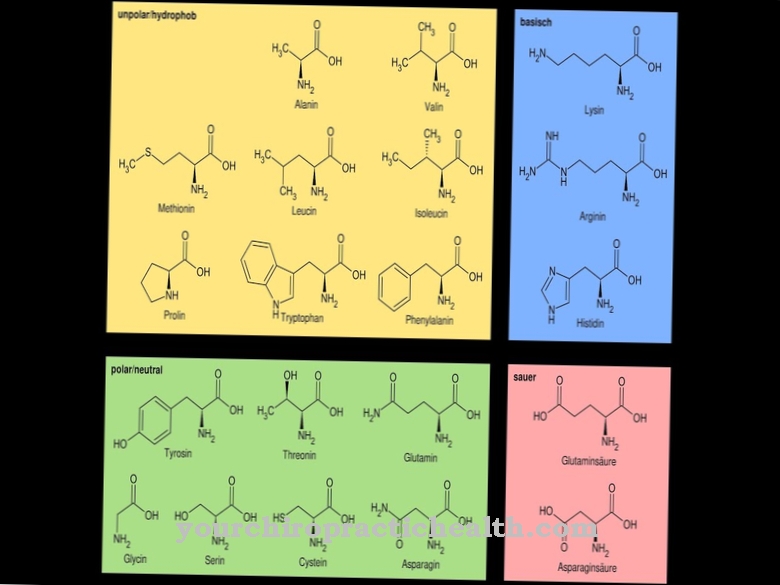
Chymotrypsyna B ma za zadanie rozkładać białka w jelicie cienkim. Enzym działa najskuteczniej w warunkach podstawowych. Pepsyna, enzym trawienny, już zaczyna rozkładać białka w żołądku. Tutaj białka są rozkładane na peptydy.
W jelicie cienkim rozkład białka jest następnie kontynuowany między innymi przez chymotrypsynę B. Już skrócone łańcuchy białkowe są rozkładane na pojedyncze aminokwasy przez enzym trawienny. W tej postaci małe składniki białkowe mogą być wchłaniane przez błonę śluzową jelita i docierają do wątroby przez krew. Tam są dalej przetwarzane. W przeciwieństwie do trypsyny, chymotrypsyna B ma również działanie krzepnięcia mleka.
Choroby i zaburzenia
Niedobór chymotrypsyny B jest zwykle związany z niedoborem wszystkich enzymów trzustkowych. Ten niedobór jest zwykle wynikiem choroby trzustki. Nazywa się to również zewnątrzwydzielniczą niewydolnością trzustki (EPI).
Choroba może mieć różne przyczyny. U dzieci najczęstszą przyczyną jest mukowiscydoza. Jest to wrodzona choroba dziedziczna charakteryzująca się gęstą wydzieliną w różnych narządach. Oprócz płuc obejmuje to również trzustkę. U dorosłych EPI jest zwykle wynikiem ciężkiego zapalenia trzustki (pancreatitis). Ostre zapalenie trzustki ze zniszczeniem tkanek jest zwykle spowodowane kamieniami żółciowymi lub infekcjami wirusowymi. Przewlekłe zapalenie trzustki jest zwykle wynikiem nadużywania alkoholu. Ale inne choroby genetyczne lub idiopatyczne mogą również powodować niewydolność trzustki.
W rezultacie trzustka może wytwarzać enzymy lub prekursory enzymów, takich jak trypsynogen lub chymotrypsynogen, tylko w ograniczonym zakresie. Jeśli tych enzymów brakuje teraz w przewodzie pokarmowym, białka nie mogą już zostać rozbite, a co za tym idzie, nie mogą być już wchłaniane przez błonę śluzową jelit. To zaburzenie trawienne jest również znane jako maldigestion. To także obciąża błonę śluzową jelit.Rozwijają się kosmki z atrofią jelit i stan zapalny. Często dochodzi również do nieprawidłowej kolonizacji jelita szkodliwymi bakteriami.
Choroba objawia się przewlekłą utratą wagi. Fizjologiczny przyrost masy ciała nie występuje u dzieci. Nawet zwiększone spożycie pokarmu nie może zatrzymać utraty wagi ani prowadzić do jej zwiększenia. Stolec chorych jest raczej lekki, brzydko pachnie i jest obszerny. W terminologii medycznej jest to określane jako steatorrhea, tłuszczowy stolec. Może również wystąpić biegunka. Jeśli zbyt mało witaminy K zostanie wchłonięte przez błonę śluzową jelit, może to prowadzić do zwiększonej skłonności do krwawień. Test na sekretynę i pankreozyminę powinien być zwykle stosowany, jeśli podejrzewa się niewydolność trzustki. Jednakże, ponieważ jest to bardzo złożone, stężenie enzymów elastazy i chymotrypsyny w kale jest zwykle określane za pomocą testu z dilaurynianem fluoresceiny.
W ostrym zapaleniu trzustki trzustka trawi się samoczynnie (autodestrukcja). W grę wchodzi również chymotrypsyna B. Niedrożność przewodu trzustkowego kamieniami żółciowymi prowadzi do zalegania soków trzustkowych i wydzielin z jelita cienkiego. Konwertaza, która aktywuje trypsynogen, jest zawarta w wydzielinie jelita cienkiego. Po aktywacji trypsyna aktywuje również inne enzymy trawienne. Enzymy trawienne zaczynają działać w trzustce i rozkładają tłuszcze, węglowodany i białka. Ale to są tłuszcze, węglowodany i białka, które tworzą trzustkę. Prowadzi to do ciężkiego stanu zapalnego.



.jpg)

-durch-vitamin-b12-mangel.jpg)