Plik Enteropeptydaza jest enzymem błony śluzowej dwunastnicy, którego funkcją jest aktywacja enzymów trzustkowych. Stanowi początek całej kaskady aktywacji enzymów trawiennych. Dysfunkcja enteropeptydazy prowadzi do złego trawienia i złego wchłaniania pokarmu w jelicie cienkim.
Co to jest enteropeptydaza?
Enteropeptydaza jest enzymem błony śluzowej dwunastnicy, który aktywuje enzymy trawienne trzustki poprzez aktywację trypsynogenu do trypsyny.
Enteropeptydaza jest wydzielana w rąbku szczoteczkowym błony śluzowej dwunastnicy. W szczególności gruczoły Liebekühna są odpowiedzialne za wydzielanie. Gruczoły Liebekühna to rurkowate zagłębienia w nabłonku jelita cienkiego i grubego. W jelicie cienkim znajdują się pomiędzy kosmkami jelita cienkiego. Gruczoły, znane również jako krypty Lieberkühna, oprócz enteropeptydazy wydzielają dużą liczbę enzymów. Wydzielanie enteropeptydazy jest stymulowane, gdy treściwa pokarmowa, która została wstępnie strawiona w żołądku, dostanie się do dwunastnicy. Sam enzym nie wpływa na składniki żywności.
Dopiero aktywacja enzymu trypsyny wprawia w ruch całą kaskadę aktywacji enzymów trawiennych. Enteropeptydaza, podobnie jak trypsyna i inne proteazy trzustki, jest proteazą serynową. Centrum aktywne zawiera katalityczną triadę kwasu asparaginowego, histydyny i seryny. Jako endopeptydaza, enteropeptydaza rozszczepia białka tylko w pewnych charakterystycznych punktach z określonymi motywami rozpoznawczymi w sekwencji aminokwasowej. Enzym zawsze rozszczepia motyw rozpoznawczy Asp-Asp-Asp-Asp-Lys. W przypadku trypsynogenu heksapeptyd Val- (Asp) 4-Lys jest rozszczepiany, przy czym powstaje trypsyna.
Funkcja, efekt i zadania
Zadaniem enteropeptydazy jest aktywacja enzymów trawiennych w trzustce. To tylko inicjuje pierwszy etap aktywacji, wraz z konwersją trypsynogenu do trypsyny.
Trypsyna jest z kolei proteazą serynową, która rozszczepia białka w oparciu o ten sam charakterystyczny motyw rozpoznawczy. Teraz kontynuuje aktywację samego trypsynogenu. Jednocześnie aktywuje inne enzymy trzustkowe z ich odpowiednich prekursorów, takich jak chymotrypsynogen, proelastaza, pro-karboksypeptydaza, pro-fosfolipaza i proenteropeptydaza. Enteropeptydaza jest również początkowo w nieaktywnej proformie. Kiedy pokarm dostaje się do dwunastnicy, wydzielana jest nie tylko proenteropeptydaza, ale również dwunastnica, która aktywuje proformę enteropeptydazy. Po rozpoczęciu kaskady aktywacji trypsyna przejmuje aktywację wszystkich enzymów trzustkowych, w tym proenteropeptydazy i trypsynogenu.
Aktywacja proenteropeptydazy do enteropeptydazy odbywa się jeszcze skuteczniej poprzez działanie trypsyny niż przez dwunastnicę. Niezwykle ważna jest pierwotna obecność enzymów trawiennych w ich nieaktywnej postaci. W szczególności działanie proteaz jest niespecyficzne. Wszystkie białka, które zawierają charakterystyczny motyw rozpoznawczy w cząsteczce, są rozszczepiane hydrolitycznie. Gdyby enzymy były natychmiast aktywne katalitycznie, własne białka organizmu byłyby już trawione w trzustce i przewodzie trzustkowym. W rezultacie trzustka rozpuściłaby się. Aktywacja ma miejsce tylko w dwunastnicy poza gruczołami zewnątrzwydzielniczymi.
Tutaj enzymy mogą zacząć rozkładać składniki pożywienia bez atakowania własnych tkanek organizmu. Aby zapobiec przedwczesnej aktywacji enzymów, w przewodzie trzustkowym działa dodatkowy inhibitor trypsyny. Jednak kluczową rolę w kaskadzie trawiennej odgrywa trypsyna. Po aktywacji tego enzymu nie można zatrzymać aktywacji wszystkich enzymów trawiennych, w tym enteropeptydazy.
Edukacja, występowanie, właściwości i optymalne wartości
Podobnie jak wszystkie proteazy serynowe, enteropeptydaza ma również niespecyficzne działanie i rozszczepia białka za pomocą charakterystycznego motywu rozpoznawczego. Enteropeptydaza składa się z lekkiego i ciężkiego łańcucha połączonych mostkami dwusiarczkowymi. Domena proteazy serynowej znajduje się w łańcuchu lekkim.
Łańcuch ciężki ma masę cząsteczkową od 82 do 140 kilodaltonów, a masa cząsteczkowa łańcucha lekkiego wynosi od 35 do 62 kilodaltonów. Struktura łańcucha lekkiego enteropeptydazy jest podobna do innych proteaz serynowych, trypsyny i chymotrypsyny. Łańcuch ciężki jest związany z błoną i wpływa na specyficzność enzymu. Stwierdzono, że wyizolowany łańcuch lekki ma podobny wpływ na charakterystyczny motyw rozpoznawczy - (Asp) 4-Lys-, ale znacznie mniejszy wpływ na trypsynogen.
Choroby i zaburzenia
Ludzka enteropeptydaza jest kodowana przez gen ENTK na chromosomie 21. Mutacja tego genu może prowadzić do poważnych chorób u dotkniętych nią dzieci.
Enzym nie może już aktywować innych enzymów trawiennych. Składniki pokarmu nie są już rozkładane i dlatego nie mogą być już wchłaniane przez jelito cienkie. Jest to przede wszystkim kwestia złego trawienia (niedostatecznego rozkładu), co prowadzi do złego wchłaniania składników pokarmowych. Ciało nie jest już odpowiednio zaopatrywane w składniki odżywcze. Brak wzrostu, zahamowanie wzrostu i typowe objawy niedoboru białka wraz z rozwojem obrzęku. Jednocześnie oprócz białek słabo wchłaniane są węglowodany i tłuszcze. Ponieważ niestrawione składniki pokarmu dostają się do jelita grubego i są tam rozkładane w wyniku fermentacji i gnilnych bakterii, występują również wzdęcia, biegunka i bóle brzucha.
Jak dotąd na całym świecie opisano 15 przypadków wrodzonego niedoboru enteropeptydazy. Jednak objawy tego stanu są znacznie częstsze. Niedobór enteropeptydazy nie zawsze musi być obecny. Ponieważ trypsyna odgrywa kluczową rolę w aktywacji enzymów trawiennych, defekt lub niedobór trypsyny również prowadzi do podobnych objawów. Leczenie tych chorób jest takie samo w obu przypadkach. Enzymy podaje się w postaci aktywowanej. Z pewnością jest o wiele więcej nierozpoznanych przypadków niedoboru enteropeptydazy.
Jeśli diagnoza jest pewna, można również zastąpić enteropeptydazę. Niedobór enteropeptydazy jest również wtórnie wyzwalany przez ciężkie choroby jelit.W diagnostyce różnicowej należy wyjaśnić takie choroby, jak celiakia, skrócone jelito cienkie, niedobór laktazy lub inne.

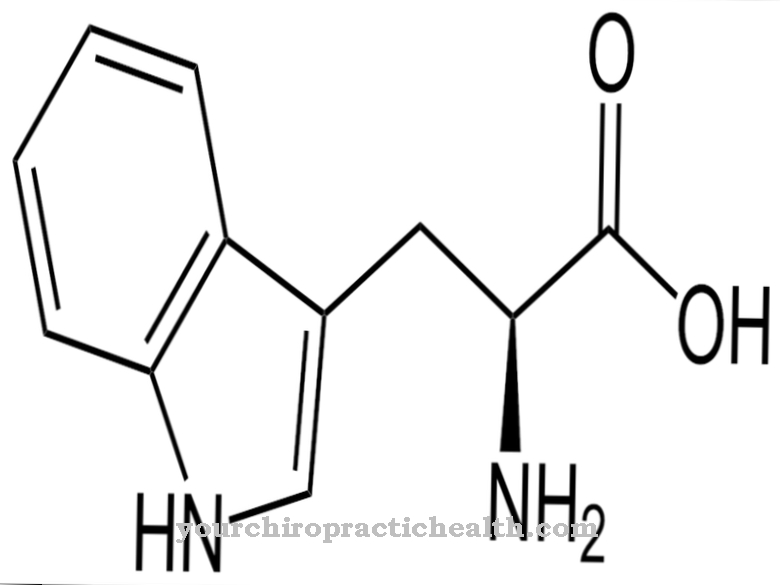
.jpg)



-durch-vitamin-b12-mangel.jpg)