G-CSF jest hormonem peptydowym, który stymuluje tworzenie granulocytów. Dlatego ma ogromne znaczenie dla funkcjonowania układu odpornościowego. Hormon jest również podawany jako lek pacjentom z silnie osłabionym układem odpornościowym w celu stymulowania produkcji neutrofili.
Co to jest G-CSF?
G-CSF to skrót nazwy Czynnik stymulujący tworzenie kolonii granulocytów. Jest to hormon peptydowy, który stymuluje tworzenie granulocytów z pluripotencjalnych komórek macierzystych. Czynnik stymulujący tworzenie kolonii granulocytów należy do cytokin.
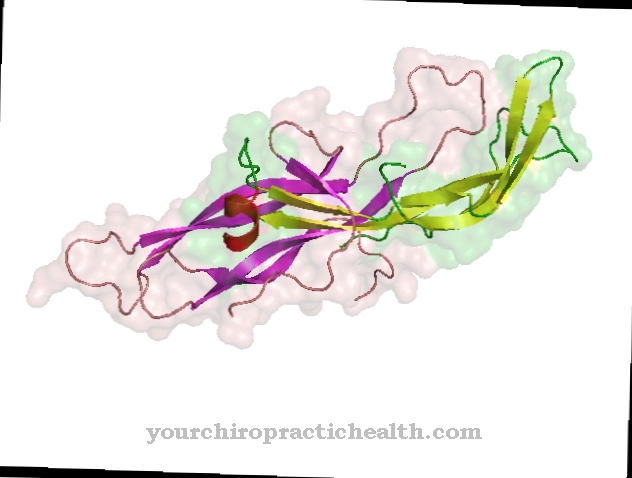
Ogólnie cytokiny są białkami odpowiedzialnymi za proliferację komórek odpornościowych, a tym samym kontrolują odpowiedź immunologiczną. Istnieją różne rodzaje cytokin. Hormon peptydowy G-CSF jest jednym z czynników stymulujących kolonie. Pod względem chemicznym ludzki G-CSF jest glikoproteiną zbudowaną z 174 aminokwasów, aw 133 znajduje się aminokwas treonina, która jest glikozylowana w swojej grupie hydroksylowej. Nieproteogenna część cząsteczki w miejscu glikozylacji stanowi około 4% masy cząsteczkowej. Składa się ze składników: kwasu α-N-acetyloneuraminowego, N-acetylo-galaktozaminy i β-galaktozy.
Glikozylacja działa stabilizująco na białko. Jednocześnie pełni również ważną rolę w niektórych funkcjach, takich jak aktywacja dojrzałych granulocytów do zwalczania obecnych źródeł infekcji. G-CSF zawiera również dwa mostki dwusiarczkowe, które określają drugorzędową strukturę białka. Gen kodujący G-CSF znajduje się na chromosomie 17 u ludzi.
Funkcja, efekt i zadania
Jak wspomniano wcześniej, G-CSF jest ważnym czynnikiem w układzie odpornościowym. Stymuluje niedojrzałe komórki progenitorowe układu krwiotwórczego (układu krwiotwórczego lub pre-CFU) do różnicowania i proliferacji. Oznacza to, że niezróżnicowane pluripotencjalne komórki macierzyste pod wpływem G-CSF różnicują się w granulocyty i namnażają poprzez podział komórkowy.
Granulocyty to neutrofilne białe krwinki, które działają jako tak zwane fagocyty. Te stają się skuteczne, gdy organizm jest zakażony bakteriami. Przy każdej infekcji bakteryjnej fagocyty namnażają się z niezróżnicowanych komórek progenitorowych. G-CSF stymuluje również dojrzałe granulocyty do przemieszczania się do źródeł infekcji w celu zabicia tamtejszych bakterii. W tej funkcji cząsteczka jest wspierana przez resztę związaną z glikozylacją. U źródła zakażenia G-CSF może zatem zwiększać tworzenie się nadtlenku wodoru w granulocytach, co sprawia, że zabijanie bakterii jest jeszcze skuteczniejsze.
Trzecią funkcją G-CSF jest powodowanie odrywania się hematopoetycznych komórek progenitorowych od ich środowiska w szpiku kostnym. Oznacza to, że niektóre z tych komórek dostają się do krwi obwodowej. Przy pomocy kolejnych dawek G-CSF proces ten można powtórzyć, dzięki czemu we krwi gromadzą się pluripotencjalne komórki macierzyste. Ten proces jest również znany jako afereza. Afereza okazała się przydatna w przypadku dawców komórek macierzystych lub pacjentów narażonych na intensywną chemioterapię. W ten sposób pacjenci poddawani chemioterapii mogą ponownie przeszczepić własną krew wzbogaconą o komórki macierzyste.
Z drugiej strony dawcy komórek macierzystych mogą oddawać krew w normalny sposób zamiast szpiku kostnego. Dlatego G-CSF służy jako substancja lecznicza i jest stosowany w przewlekłej neutropenii (zmniejszenie liczby granulocytów obojętnochłonnych), w chemioterapii lub przy przeszczepach komórek macierzystych.
Edukacja, występowanie, właściwości i optymalne wartości
G-CSF jest zintegrowany ze złożoną siecią homeostatyczną organizmu. Czynnik stymulujący tworzenie kolonii granulocytów jest częścią zarówno układu odpornościowego, jak i układu hormonalnego. Pluripotencjalne komórki macierzyste szpiku kostnego i dojrzałe granulocyty neutrofilów mają receptory dla G-CSF.
W razie potrzeby białka G-CSF wiążą się z receptorami i zapewniają w ten sposób rozwój ich działania. Każdy organizm tworzy swój własny G-CSF. Jeśli jednak potrzeba wzrośnie, na przykład w przypadku ciężkich infekcji, chemioterapii lub ogólnego niedoboru odporności, może być konieczne wstrzyknięcie hormonu podskórnego. Dobrze znanymi lekami są pegfilgrastym i lipegfilgrastim. Są one wytwarzane metodą rekombinacji z pewnych komórek ssaków, takich jak komórki CHO (jajnik chomika chińskiego) lub z Escherichia coli. Sekwencje aminokwasów są identyczne w obu formach produkcji.
Mogą występować różnice w glikozylacji. Jednak nowsze produkty są glikozylowane w tej samej pozycji, co oryginalny G-CSF. Niektóre formy przetwarzania, takie jak PEGylacja, zwiększają odporność i okres półtrwania leków, gdy są stosowane, bez zmiany ich skuteczności. W tym celu G-CSF wiąże się chemicznie z glikolem polietylenowym.
Choroby i zaburzenia
Podczas stosowania G-CSF mogą również wystąpić skutki uboczne. Najczęstsze są bóle kości i mięśni. Często towarzyszą temu nudności, wymioty, utrata apetytu i biegunka. Może również wystąpić zapalenie błon śluzowych i wypadanie włosów. Dolegliwości są wynikiem zwiększonego tworzenia się neutrofili, które następnie wywołują nasilone reakcje immunologiczne.
Rzadziej obserwuje się nacieki w płucach, które powodują między innymi kaszel, duszność i gorączkę. Może to nawet prowadzić do tak zwanego zespołu ostrej niewydolności oddechowej (ARDS), który wskazuje na intensywną reakcję płuc na zewnętrzne czynniki uszkadzające. Śledziona może się tak powiększyć, że pęka. Kolejnym objawem jest zwiększona leukocytoza, czyli zwiększone tworzenie się białych krwinek. W przypadku niedokrwistości sierpowatokrwinkowej G-CSF nie może być stosowany, ponieważ według amerykańskich badań mogą tu wystąpić poważne skutki uboczne, z których niektóre prowadzą nawet do niewydolności wielonarządowej.
Jednak wiele badań pokazuje również, że objawy są zwykle odwracalne. Po zaprzestaniu terapii G-CSF również ustępują efekty uboczne. Chociaż podczas leczenia G-CSF obserwuje się zwiększone tworzenie się neutrofili, jak dotąd badania nie wykazały zwiększonego ryzyka zachorowania na białaczkę.

.jpg)




.jpg)




.jpg)
.jpg)

.jpg)