Kalcyneuryna (Mogą) jest fosfatazą białkową, która odgrywa ważną rolę w aktywacji limfocytów T układu odpornościowego, ale jest również aktywna w innych szlakach sygnałowych w organizmie, w których pośredniczy wapń. Poprzez defosforylację białka NF-AT enzym ten inicjuje serię transkrypcji genów, które są głównie odpowiedzialne za charakterystyczną pracę limfocytów T. Dzięki tej kluczowej pozycji kalcyneuryna jest punktem wyjścia dla kilku terapeutycznych metod immunosupresji.
Co to jest kalcyneuryna?
Enzym składa się z dwóch podjednostek: kalcyneuryna A (ok. 60 kDa) pełni funkcję katalityczną i ma miejsce wiązania kalmoduliny, natomiast kalcyneuryna B (ok. 19 kDa) jest aktywna regulatorowo i ma dwa miejsca wiązania jonów wapnia.
W stanie podstawowym CaN jest nieaktywny, ponieważ część białka blokuje centrum aktywne - nazywa się to autohamowaniem. Do pełnej aktywacji wymagane jest wiązanie kalmoduliny aktywowanej wapniem i jonów wapnia. Jako fosfatazie kalcyneurynie przypisano numer EC 3.1.3.16, który obejmuje te enzymy, które katalizują hydrolityczną defosforylację reszt seryny i treoniny w innych białkach.
Funkcja, efekt i zadania
Miejsce wiązania substratu przez enzym jest szczególnie selektywne dla NF-ATc (czynnik jądrowy aktywowanych komórek T, cytozol). Ten czynnik transkrypcyjny znajduje się w osoczu komórkowym limfocytów. W stanie podstawowym NF-Atc jest fosforylowany, a zatem nieaktywny.
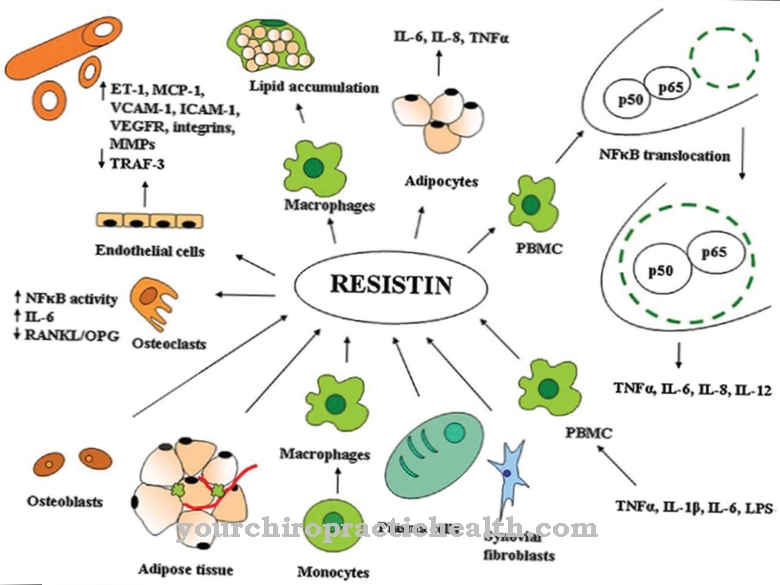
Rola kalcyneuryny w odpowiedzi immunologicznej zaczyna się od pobrania antygenu - np. wirusa, bakterii lub składników komórek zdegenerowanych - przez komórkę układu odpornościowego (monocyty, makrofagi, komórki dendrytyczne i komórki B). Substancja ta jest następnie przetwarzana i prezentowana na powierzchni komórki.
Kiedy komórki prezentujące antygen wchodzą w kontakt z receptorem komórek T komórek T, zostaje uruchomiona kaskada sygnału. Te zewnątrzkomórkowe bodźce zwiększają stężenie wapnia w komórce. Jony wapnia wiążą się z CaN B, który poprzez zmianę struktury białka rozpuszcza domenę autoinhibitorową CaN A i pośredniczy w wiązaniu kalmoduliny z CaN A. To sprawia, że kalcyneuryna jest w pełni katalitycznie aktywna i defosforyluje region bogaty w serynę (SRR) na końcu aminowym NF-ATc. Powoduje to zmianę konformacyjną NF-ATc, w wyniku której czynnik transkrypcyjny jest transportowany do jądra komórkowego. Tam wyzwala transkrypcję kilku genów, które są między innymi odpowiedzialne za produkcję interleukin, takich jak IL-2.
IL-2 zapewnia również aktywację limfocytów T pomocniczych oraz syntezę cytokin, kierując tym samym pracą cytotoksycznych limfocytów T. Podczas gdy komórki pomocnicze kontrolują inne limfocyty w odpowiedzi immunologicznej - np. poprzez dojrzewanie komórek B do komórek plazmatycznych lub komórek pamięci oraz aktywację fagocytów - cytotoksyczne limfocyty T są odpowiedzialne za niszczenie zakażonych lub zdegenerowanych komórek organizmu. Ponieważ tej ścieżki nie można podążać bez kalcyneuryny, enzym odgrywa kluczową rolę w odpowiedzi immunologicznej.
Kolejnymi białkami docelowymi enzymu są białko wiążące element odpowiedzi cAMP (CREB) z wpływem np. na układ nerwowy i wewnętrzny zegar oraz czynnik wzmacniający miocyty 2 (MEF2), który jest częściowo odpowiedzialny za różnicowanie komórek w rozwoju embrionalnym i odgrywa rolę w odpowiedzi na stres niektórych tkanek u dorosłych.
Edukacja, występowanie, właściwości i optymalne wartości
Istnieją różne izoformy dwóch podjednostek (izoformy CaN A: 3, izoformy CaN B: 2), z których niektóre są wyrażane w różny sposób w zależności od regionu ciała. W szczególności wyróżnia się CaN A γ, który występuje wyłącznie w jądrach i bierze tam udział w dojrzewaniu nasion. Pomimo ważnej roli, jaką odgrywa w układzie odpornościowym i nerwach, można przypuszczać, że kalcyneuryna występuje w prawie wszystkich tkankach. Regulacja zachodzi w mniejszym stopniu poprzez wzrost lub spadek syntezy, ale przez inhibitor kalcyneuryny CAIN. Zapobiega to np. defosforylacja NF-AT.
Regulacja ujemnego sprzężenia zwrotnego przez RCAN1 zapewnia, że nie występuje zbyt wysokie stężenie cytozolowe CaN. Aktywowany (defosforylowany) NF-AT wiąże się z promotorem genu RCAN1 w jądrze komórkowym i tym samym wyzwala transkrypcję. Powstały RCAN1 wiąże się z CaN i hamuje jego aktywność.
Choroby i zaburzenia
Kalcyneuryna jest celem inhibitorów kalcyneuryny, takich jak Cyklosporyna, pimekrolimus i takrolimus. Hamując działanie fosfatazy CaN wywoływana jest immunosupresja, która np. po przeszczepach narządów w celu zmniejszenia prawdopodobieństwa odrzucenia lub w chorobach autoimmunologicznych w celu zwalczania procesów zapalnych.
Zatem inhibitory CaN są również stosowane w leczeniu chorób z grupy reumatoidów. Inne podejścia, które są obecnie badane, to walka z gruźlicą, schizofrenią i cukrzycą. Wyłączna obecność CaN A γ w jądrach wskazuje na możliwą rolę w rozwoju środków antykoncepcyjnych. W przypadku przerostu mięśnia sercowego, w którym zaangażowany jest szlak sygnałowy CaN-NA-FT, rozwojowi hipertrofii można zapobiec, stosując inhibitory CaN.
Osoby z zespołem Downa mają trzy 21 chromosomów zamiast zwykłych dwóch, które kodują białko hamujące kalcyneurynę. Inhibitor ten zapobiega oddziaływaniu kalcyneuryny z komórkami naczyń krwionośnych i wyzwalaniu w nich procesów proliferacji. Fakt ten jest szczególnie ważny w przypadku guzów, ponieważ zapewniają one między innymi ukrwienie poprzez kalcyneurynę. Interwencja w tym momencie może skutecznie zapobiec postępowi raka. Możesz więc znaleźć np. znacznie mniejsza zapadalność na nowotwory u osób z zespołem Downa i ma nadzieję, że ukierunkowane zahamowanie tego procesu przyniesie korzyści w walce z rakiem w przyszłości.
Ostatnio pojawia się również coraz więcej dowodów na to, że związana z wiekiem rozregulowanie kalcyneuryny może również odgrywać rolę w rozwoju chorób neuronalnych, takich jak choroba Alzheimera. Badania nad szlakami sygnałowymi, w których bierze udział enzym, ujawniają coraz więcej białych plam na mapie biochemicznej. Jednocześnie rodzi nadzieję, że dzięki temu kluczowemu białku będziemy w stanie lepiej zrozumieć i leczyć wiele różnych chorób w przyszłości.



-durch-vitamin-b12-mangel.jpg)