Elastazy reprezentują grupę proteaz, które są blisko spokrewnione z enzymami trypsyną i chymotrypsyną. Należą do proteaz serynowych. Jak dotąd dla organizmu ludzkiego znanych jest dziewięć enzymów należących do elastaz.
Co to są elastazy?
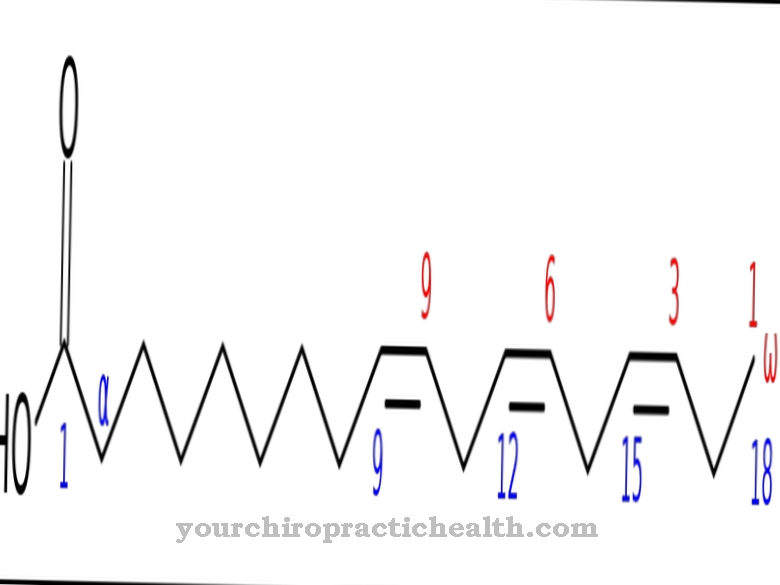
Elastazy to nieswoiste proteazy, które występują we wszystkich organizmach zwierzęcych i ludzkich. Nazwa wzięła się stąd, że między innymi potrafią rozkładać własną elastynę organizmu. Elastazy należą do proteaz serynowych.
W ich centrum aktywnym znajduje się tak zwana triada katalityczna kwasu asparaginowego, seryny i histydyny. Ponadto elastazy również należą do endoproteaz. Nie rozkładają białek i łańcuchów polipeptydowych krok po kroku, ale dzielą je na określone aminokwasy i charakterystyczne sekwencje aminokwasowe. Białko jest rozkładane w łańcuchu peptydowym. Działanie elastaz nie jest specyficzne. W ten sposób z elastyny można również rozkładać własne białka organizmu. Dlatego działanie tych enzymów musi być ograniczane przez inhibitory elastazy. Rozróżnia się dwa rodzaje elastaz.
Istnieją elastazy trzustkowe i elastazy granulocytowe. Jak sama nazwa wskazuje, elastazy trzustkowe (elastaza 1) są wydzielane z trzustki. Elastaza granulocytów (elastaza 2) jest zlokalizowana w granulocytach neutrofili. Niedobór elastazy 1 w kale jest uważany za dowód niewydolności trzustki.
Funkcja, efekt i zadania
Elastazy mają za zadanie zrywanie wiązań peptydowych w białkach lub łańcuchach polipeptydowych. W procesie tym powstają mniejsze łańcuchy peptydowe lub pojedyncze aminokwasy. Elastaza trzustkowa wspomaga proteazy, trypsynę i chymotrypsynę w rozkładaniu białek pokarmowych.
Powstaje w trzustce jako nieaktywny proenzym (zymogen), a po uwolnieniu w jelicie cienkim ulega przekształceniu do postaci aktywnej pod działaniem trypsyny. Od zymogenu oddziela się częściowy łańcuch. Elastaza 1 rozkłada w szczególności elastynę białka włókna. Elastyna wchodzi w skład tkanki łącznej płuc, naczyń krwionośnych i skóry. Pełni głównie funkcję wspomagającą w organizmie. Elastyna nadaje narządom kształt i wsparcie. Ponieważ tworzy sieci białkowe poprzez agregację czterech cząsteczek lizyny, nie może zostać rozbita przez wiele proteaz. Jednak Elastase 1 ma taką możliwość. Składniki elastyny z pożywienia są rozkładane i mogą być dalej przetwarzane i rozkładane na aminokwasy.
Niestety działanie elastazy jest niespecyficzne, przez co może atakować także struktury elastyny organizmu. Aby to zrobić, organizm wytwarza białka hamujące elastynę, które mogą kontrolować destrukcyjne działanie elastyny. Białka te obejmują α1-antytrypsynę, alfa-2-makroglobulinę lub elafinę. Druga grupa elastaz jest reprezentowana jako ELA-2, elastaza granulocytów. Ich zadaniem jest rozkładanie mikroorganizmów, które uległy fagocytozie w ramach odpowiedzi immunologicznej na infekcje. Jednak mają również niespecyficzne działanie i atakują własną elastynę organizmu. Jeśli działanie białek inhibitora elastazy jest ograniczone, tkanka płucna może zostać zniszczona, co powoduje rozedmę.
Edukacja, występowanie, właściwości i optymalne wartości
Niezależnie od miejsca syntezy elastazy są ważnymi wspomagaczami układu odpornościowego w walce z bakteriami Gram-ujemnymi w przewodzie pokarmowym, płucach i na ranach. W ten sposób rozszczepiają odpowiednie białka po stronie karboksylowej aminokwasów hydrofobowych, w tym walinę, glicynę i alaninę. Jednak, jak już wspomniano, ich działanie jest zawsze niespecyficzne.
Ludzkie ciało zużywa codziennie około 500 miligramów elastazy. Elastaza nie ulega rozkładowi w organizmie. Jest wydalany w postaci niezmienionej z kałem. Funkcję trzustki można sprawdzić na podstawie ilości wydalonej z kałem. Chymotrypsyna jest również wydalana z kałem. Jednak oznaczenie elastazy można jaśniej wykorzystać do celów diagnostycznych. Normalne stężenie elastazy wynosi co najmniej 200 mikrogramów na gram stolca.
Choroby i zaburzenia
Zbyt niski poziom elastazy w stolcu wskazuje na niewydolność trzustki. Jeśli wartość wynosi od 100 do 200 mikrogramów na gram kału, jest to kwestia łagodnej do umiarkowanej dysfunkcji trzustki.
Ciężka niewydolność trzustki występuje przy wartościach poniżej 100 mikrogramów. Wykrywanie elastazy w kale jest charakterystyczną cechą diagnostyczną niedoczynności trzustki. To jest zewnątrzwydzielnicza funkcja trzustki. Tworzenie insuliny może pozostać niezmienione. W przypadku niewydolności trzustki wydziela się zbyt mało enzymów trawiennych. Dotyczy to proteaz, a także lipaz i amylaz. Wiele składników pokarmu dociera do jelita grubego w postaci niestrawionej, gdzie są dalej rozkładane przez bakterie chorobotwórcze. Patogenne zarazki mogą się rozwijać tylko wtedy, gdy jest jeszcze wystarczająco dużo niestrawionych składników żywności. Rozwijają się procesy gnilne i fermentacyjne, które prowadzą do wzdęć, biegunki i dolegliwości brzusznych.
Ponieważ tłuszcze nie są już rozkładane, mogą pojawić się tłuste stolce. Przyczyną niedoczynności trzustki może być ostre lub przewlekłe zapalenie trzustki. Zapalenie trzustki zwykle wynika z samoczynnego trawienia części trzustki przez nie drenujące soki trawienne. Wylot trzustki może być zwężony z powodu guzów lub kamieni żółciowych. Możliwe są również zaburzenia drenażu spowodowane wadami rozwojowymi. Długotrwałe przewlekłe zapalenie trzustki prowadzi do upośledzenia funkcji trzustki i zmniejszenia produkcji enzymów. Jeśli występuje niedobór elastazy 2 elastazy z powodu defektu genetycznego, układ odpornościowy chorego pacjenta jest osłabiony. Nieustannie występują infekcje zagrażające życiu.
Jeśli brakuje inhibitorów elastazy, takich jak alfa-1-antytrypsyna lub zwiększona aktywność elastazy w zapaleniu płuc, czynność płuc może być poważnie ograniczona. W dłuższej perspektywie rozwija się z tego powodu rozedma płuc. W przypadku genetycznego niedoboru alfa-1-antytrypsyny stosuje się dożywotnią terapię substytucyjną z użyciem genetycznie modyfikowanej alfa-1-antytrypsyny.





.jpg)
.jpg)