Tak jak Proroctwo DNA faga umiarkowanych bakteriofagów jest nazywane, gdy jest obecne w bakteryjnej komórce gospodarza. Bakteriofagi odkrył Félix Hubert d'Hérelle w 1917 roku. Są to wirusy, które przystosowały się do określonych bakterii. W dalszym toku badań wyróżniono faga litycznego o wysokiej zjadliwości oraz faga umiarkowanego z cichym profagiem i cyklem lizogennym.
Co to są prorocy?
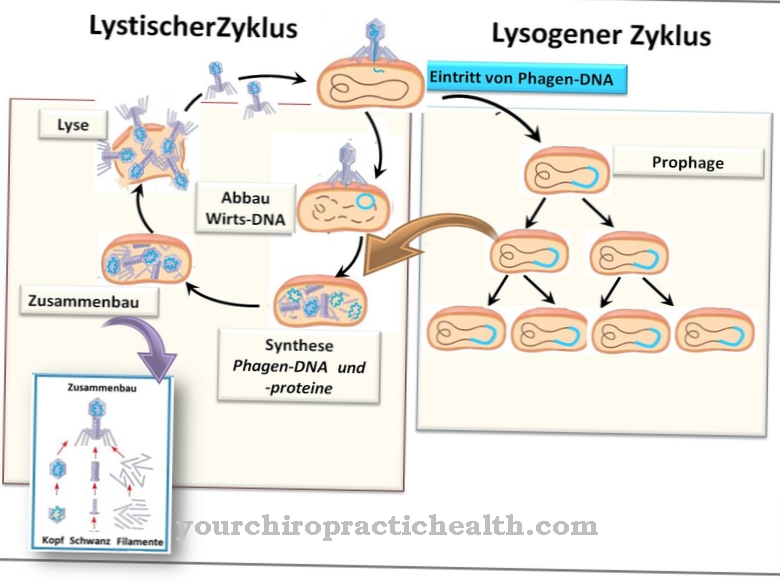
Profag bakteriofaga umiarkowanego może występować jako plazmid w komórce gospodarza lub być zintegrowany z bakteryjnym DNA. W tym celu fag umiarkowany musi przyjąć cykl lizogenny, gdy wstrzykuje się DNA faga. Rozróżnia się cykl lityczny i lizogenny. Podczas gdy cykl lityczny powoduje szybką replikację, a następnie lizę komórki gospodarza po wstrzyknięciu materiału genetycznego, w lizogennym cyklu geny represorowe faga wstrzykuje się do komórki gospodarza w celu zahamowania cyklu litycznego, tj. Szybkiego rozpuszczenia komórki.
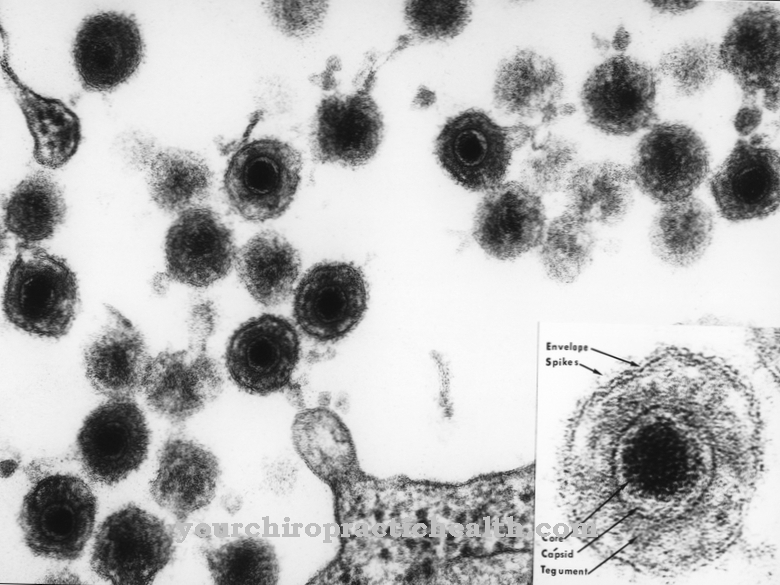
Umiarkowany fag może przełączać się między cyklem litycznym i lizogennym w zależności od przeważających warunków środowiskowych. Cykl lityczny odnosi się do konwencjonalnego sposobu działania genów faga w komórce gospodarza. Po wstrzyknięciu wirusowego DNA następuje szybka replikacja w komórce gospodarza. Po replikacji kapsydu i białek włókna ogona oprócz wirusowego DNA i po złożeniu wielu nowych cząstek wirusa z poszczególnych części, ściana komórkowa komórki gospodarza jest rozkładana przez lizozym. Kiedy ściana komórkowa się rozpuści, nowe fagi są uwalniane, a ich DNA można teraz wstrzyknąć do innych komórek bakteryjnych. Ten proces trwa około godziny.
Ze względu na dużą liczbę nowych cząstek wirusów podejście to określa się jako „zjadliwą postać”. Ponieważ ściana komórkowa gospodarza jest niszczona przez lizozym, stosuje się termin „cykl lityczny”. W przypadku faga umiarkowanego, szybka replikacja, a następnie liza komórki gospodarza niekoniecznie musi mieć miejsce. W zależności od istniejących czynników środowiskowych, umiarkowany fag może przełączać się między cyklem litycznym i lizogennym. Cykl lityczny można stłumić przez wstrzyknięcie genów represorowych, a cykl lizogenny może rozpocząć się w nieskończoność.
W cyklu lizogennym materiał genetyczny faga jest wprowadzany do materiału genetycznego zarazka i może tu przetrwać przez czas nieokreślony. Wstrzyknięty materiał genetyczny jest określany jako „nieruchomy” i definiowany jako „profag”. Profag może leżeć jako plazmid w cytoplazmie komórki gospodarza lub być zintegrowany z materiałem genetycznym bakterii.
Integracja wirusowego materiału genetycznego wymaga wysokiego stopnia specjalizacji. Genom umiarkowanych fagów może być przyłączony tylko do określonych pozycji w bakteryjnym DNA. I odwrotnie, materiał genetyczny poszczególnych szczepów fagów umiarkowanych można zawsze zidentyfikować w tych samych miejscach w genomie bakteryjnym.
Udana adaptacja czyni profagów beneficjentami podziału komórek bakteryjnych. Kiedy komórka gospodarza dzieli mitozę, przekazywany jest wirusowy materiał genetyczny. Dalsza transmisja do innych bakterii może nastąpić poprzez koniugację. Prorocy mogą więc rozprzestrzeniać się różnymi drogami na całe szczepy bakterii. Ze względu na wpływy środowiska, takie jak światło UV lub niektóre chemikalia, profag może wrócić do cyklu litycznego i dążyć do agresywnej replikacji.
Profag wykorzystuje również procesy transkrypcyjne komórki gospodarza: wstrzyknięte geny represorowe faga są rozpoznawane jako uszkodzenie DNA przez pewne enzymy bakterii i rozkładane. Degradacja genów represora ma charakter autodestrukcyjny w komórce gospodarza. Cykl lityczny nie może już zostać zahamowany, a profag przechodzi ze stanu lizogennego do agresywnej replikacji, która kończy się późniejszym rozpuszczeniem ściany komórkowej bakterii.
Występowanie, dystrybucja i właściwości
Fagi to wysoce wyspecjalizowane wirusy, które przystosowały się do poszczególnych szczepów bakterii. Dlatego nie każdy bakteriofag ma dostęp do każdej bakterii. Namnażanie bez określonej komórki gospodarza nie jest możliwe w przypadku bakteriofaga. Wysoki poziom specjalizacji oznacza, że bakteriofagi można znaleźć na tym samym terenie, co ich komórki gospodarze.
To samo dotyczy w jeszcze większym stopniu proroków. Ponieważ profagi nie są konwencjonalnymi wirusami i występują tylko jako wirusowy materiał genetyczny w organizmie gospodarza, nie można ich znaleźć poza przypisanymi komórkami ze względu na samą definicję.
Ponadto należy wspomnieć, że same bakteriofagi w wodzie morskiej mają liczbę (od 10 do potęgi 30), a zatem na całej planecie występuje więcej fagów niż istot żywych. Z kolei istnieje bardzo mała liczba dziewiętnastu oficjalnie przebadanych bakteriofagów, co utrudnia precyzyjne stwierdzenie zdarzenia.
Znaczenie i funkcja
Terapia fagowa została opracowana w latach dwudziestych XX wieku i do dziś jest z powodzeniem stosowana w Europie Wschodniej w zwalczaniu różnych chorób zakaźnych. Zalety fagoterapii są oczywiste: bakteriofagi uszkadzają tylko pojedyncze szczepy bakterii, podczas gdy antybiotyki mają ogólnie szkodliwy wpływ na bakterie w organizmie.
Odkrycie penicyliny w latach czterdziestych XX wieku doprowadziło do masowego stosowania antybiotyków na Zachodzie, aw rezultacie do zakończenia badań nad fagami. Późniejsze nagromadzenie się licznych oporności na antybiotyki wywołało w latach 90. wzrost zainteresowania bakteriofagami.
Terapia fagowa skupia się na bakteriofagach z agresywną wirulencją i wyłącznie cyklem litycznym, podczas gdy umiarkowane bakteriofagi i profagi odgrywają dotychczas jedynie podrzędną rolę.
Choroby i dolegliwości
Niektóre patogeny mogą budować swoją zjadliwość tylko poprzez symbiozę z prorokami. Clostridium botulinum może wytwarzać przerażającą toksynę botulinową tylko przy pomocy zintegrowanego DNA faga. Streptococcus pyogenes może wywołać szkarlatynę tylko w połączeniu z profagiem DNA.
Vibrio cholerae produkuje cholerę tylko poprzez specjalne proroctwa. To również pokazuje znaczenie fagów w medycynie człowieka. Całe szczepy bakteryjne mogłyby stracić swój potencjał patogenny, gdyby można było wyłączyć odpowiedzialnych za nie profagów.



-durch-vitamin-b12-mangel.jpg)