Trypsyna Jako enzym trzustki odpowiada za dalszy rozkład białek pokarmowych. Działa w zakresie silnie zasadowym. Niedobór trypsyny prowadzi do niedoboru białka w organizmie na skutek upośledzonego trawienia białka.
Co to jest trypsyna?
Trypsyna jest proteazą, która kontynuuje rozkład białek w zasadowym obszarze jelita cienkiego. W żołądku rozpad białek rozpoczyna się w kwaśnym środowisku przez enzym pepsynę. Enzym trypsyna składa się z trzech składników.
Są to trypsyna-1 jako kation, trypsyna-2 jako anion i trypsyna-4. Dwie trzecie enzymu składa się z trypsyny-1 i jednej trzeciej trypsyny-2. Trypsyna-4 lub mezotrypsyna występuje tylko w niewielkich ilościach. Trypsyna jest endoproteazą. Dzieli białko tylko w określonych miejscach. Jest również proteazą serynową. Jego aktywne centrum zawiera katalityczną triadę kwasu asparaginowego, histydyny i seryny. Preferencyjnie dzieli białka pokarmowe na podstawowe aminokwasy lizynę, argininę i modyfikowaną cysteinę.
Trypsyna jest wytwarzana z prekursora zymogenu, trypsynogenu, przy pomocy katalitycznego działania enzymu jelitowego enteropeptydazy. Enzym składa się z 224 aminokwasów. Trypsyna działa optymalnie przy wartości pH od 7 do 8.
Funkcja, efekt i zadania
Zadaniem trypsyny jest kontynuacja rozpadu białek, który już rozpoczął się w żołądku w zakresie zasadowym. W żołądku wstępne trawienie białek pokarmowych przez podobny enzym pepsynę rozpoczyna się w zakresie kwaśnym.
Tutaj również łańcuchy białkowe są przerywane w pewnych punktach. Podczas gdy ten rozszczepianie białek zachodzi w żołądku na aromatycznych aminokwasach, takich jak fenyloalanina, białka i polipeptydy są rozszczepiane przez trypsynę na podstawowych aminokwasach lizynie i argininie, a także na modyfikowanej cysteinie. Inną różnicą w stosunku do pepsyny jest to, że trypsyna rozwija swoje optymalne działanie w zakresie zasadowym przy wartości pH od 7 do 8. Aktywowana trypsyna przekształca również inne zymogeny, takie jak chymotrypsynogen, pro-elastaza, prokarboksypeptydaza i inne nieaktywne enzymy w aktywne enzymy.
Konwersja rozpoczyna się natychmiast po uwolnieniu trypsyny. Inne proteazy trzustki to chymotrypsyna, karboksypeptydaza lub elastyna. Ponadto trypsyna aktywuje się sama, przekształcając trypsynogen. Enzymy trzustkowe są początkowo w swojej nieaktywnej postaci, aby nie zniszczyć trzustki w wyniku samo-trawienia. Tylko wtedy, gdy nieaktywne preformy zostaną wydzielone, można je aktywować przez rozdzielenie. Po pierwsze, konwersja trypsynogenu do trypsyny jest katalizowana przez enteropeptydazę. To jedyna funkcja enteropeptydazy.
Od trypsynogenu odszczepia się heksamer z końcowym aminokwasem lizyną. Ponieważ trypsyna oddziela również łańcuchy polipeptydowe na podstawowej lizynie, teraz katalizuje również swoją własną aktywację i jednocześnie aktywację innych zymogenów. Wraz z enzymami chymotrypsyną i elastazą rozszczepia większe białka w jelicie cienkim oraz peptony (łańcuchy polipeptydowe) wytwarzane przez pepsynę na tri- i dipeptydy. Te mniejsze peptydy są następnie dalej rozkładane na aminokwasy przy pomocy innych enzymów. W szczególności trypsyna również przyczynia się do rozpadu aminokwasu metioniny. Lizyna stymuluje między innymi powstawanie trypsyny.
Edukacja, występowanie, właściwości i optymalne wartości
Trypsyna jest endogennym enzymem używanym do trawienia białek pokarmowych. Dlatego jest on zawsze wydzielany przez trzustkę krótko po jedzeniu. Jednak enzym można również pozyskać ze źródeł zwierzęcych i stosować w medycynie. Efekt rozszczepiania białek można, między innymi, wykorzystać do rozbicia własnych kompleksów białkowych organizmu. W ten sposób można rozwiązać kompleksy immunologiczne w chorobach autoimmunologicznych.
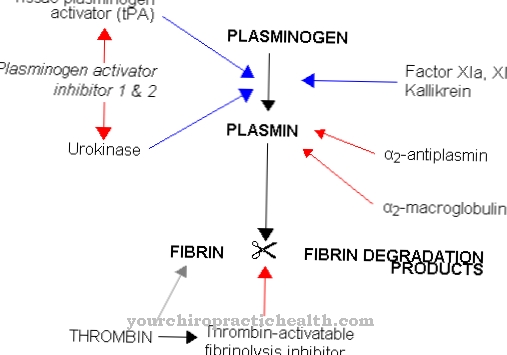
Zapalenie układu mięśniowo-szkieletowego można również dobrze leczyć trypsyną. Aktywuje również enzym plazminę z plazminogenu. Plazmina rozpuszcza fibrynę, gdy tworzy się silna skrzeplina. Za pomocą trypsyny można leczyć, a nawet zapobiegać zakrzepicy. Ponadto trypsyna przyjmowana podczas posiłków wspomaga trawienie. Stosowany na 1 do 2 godzin przed lub po posiłku rozwija działanie przeciwzapalne.
Choroby i zaburzenia
W kontekście niewydolności trzustki można ograniczyć syntezę enzymów trawiennych, takich jak trypsyna. Konsekwencją jest rozwój niestrawności. Oprócz proteaz trzustka wytwarza również lipazy i amylazy.
Jeśli brakuje enzymów, składniki żywności nie są już trawione i trafiają do okrężnicy. Na przykład, jeśli brakuje trypsyny, białko w diecie nie może być już odpowiednio trawione. Bakterie gnilne osadzają się w jelicie grubym i beztlenowo rozkładają białka. Występują ogromne problemy trawienne z wzdęciami, biegunką i bólami brzucha. Ponadto zmniejszone tworzenie się aminokwasów prowadzi do niedoboru białka i niedożywienia pomimo wystarczającego spożycia pokarmu. Jednak enzymy mogą być również dostarczane z zewnątrz.
Jednak zdarzają się również nagłe przypadki medyczne, w których własne enzymy organizmu, takie jak trypsyna, trawią samą trzustkę. Może się to zdarzyć, jeśli drogi żółciowe i trzustkowe są zablokowane. Trypsyna jest uwalniana, ale nie może dostać się do jelita cienkiego przez blokadę trzustki. Jeśli przewód trzustkowy nie zostanie otwarty w tej nagłej sytuacji, wynik będzie śmiertelny z powodu samorozpuszczenia trzustki. Nawet w przypadku guzów trzustki przewód trzustkowy może być całkowicie lub częściowo zamknięty. Działanie soków trawiennych w trzustce objawia się przewlekłym lub ostrym zapaleniem trzustki.
Brak trypsyny może być również spowodowany mutacją. Istnieją również dziedziczne formy zapalenia trzustki, w przypadku których zaburzony jest rozkład trypsyny.




.jpg)
.jpg)